
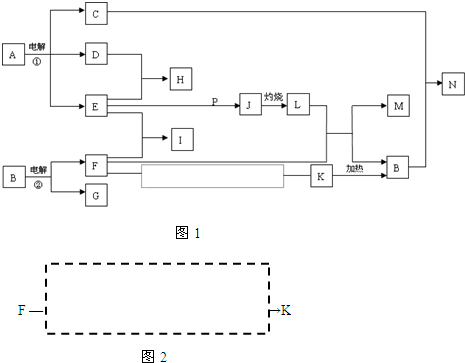
题目列表(包括答案和解析)
| A、已经制得了IBr、ICl等卤素互化物 | B、已经制得了I2O5等碘的氧化物 | C、已经制得了I(NO3)3、I(ClO4)3?2H2O等含I3+离子的离子化合物 | D、碘单质(I2)在通常情况下为具有金属光泽的紫黑色固体 |
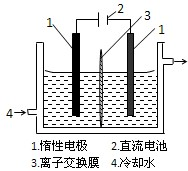 碘被称为“智力元素”,科学合理地补碘可防止碘缺乏症.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.以碘为原料,通过电解可以制备碘酸钾.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却(实验装置如右图所示).以下有关该实验的说法错误的是( )
碘被称为“智力元素”,科学合理地补碘可防止碘缺乏症.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.以碘为原料,通过电解可以制备碘酸钾.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却(实验装置如右图所示).以下有关该实验的说法错误的是( )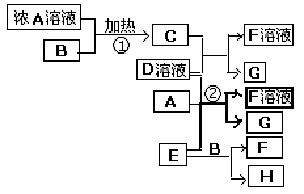 有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
| ||
| △ |
| ||
| △ |
| ||
| △ |
| ||
| △ |
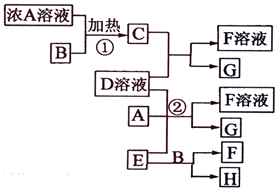 (2009?海南)有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
(2009?海南)有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
| ||
| ||
| ||
| ||
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com