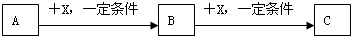
短周期元素形成的纯净物A、B、C、D、E之间的转化关系如图1所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同).

请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的化学式
Na2O2(NaH)
Na2O2(NaH)
.
(2)若E是有臭鸡蛋气味的气体硫化氢(其水溶液为二元弱酸),D是既能溶于强酸、又能溶于强碱的化合物.
用等式表示E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系
c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
.
(3)若C是一种红棕色气体,D是一种强酸,则:
①C与水反应的化学方程式为
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.
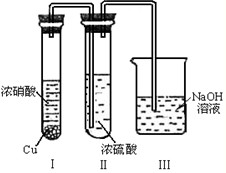
②有人认为“浓H
2SO
4可以干燥气体C”.某同学为了验证该观点是否正确,用右图装置进行实验(反应前Ⅰ、Ⅱ装置中空气已排尽).实验进行一段时间后,浓H
2SO
4中未发现有气体逸出,且该溶液变为红棕色,则你得出的结论是
NO2能溶于浓H2SO4,因而不能用浓H2SO4干燥NO2
NO2能溶于浓H2SO4,因而不能用浓H2SO4干燥NO2
.
③已知A与物质B及水作用生成D,写出此反应的化学方程式
4NO+3O2+2H2O=4HNO3
4NO+3O2+2H2O=4HNO3
.







 CH3COOH+OH-
CH3COOH+OH- CH3COOH+OH-
CH3COOH+OH-