
题目列表(包括答案和解析)
某学校同学进行乙醇的化学性质实验探究学习,以下为他们的学习过程。
(一)结构分析
(1)写出乙醇的结构式 ;官能团的电子式 。
(二)性质预测
(2)对比乙醇和乙烷的结构,经过讨论,同学们认为乙醇分子中氧原子吸引电子能力较强,预测在一定条件下分子中 键(填写具体共价键)容易发生断裂。为此,他们查阅了相关资料,获得了以下乙醇性质的部分事实。
|
下列关于乙醇结构和性质的分析、理解错误的是
A.-OH对-C2H5的影响使乙醇与钠的反应比水与钠的反应速率慢ks5u
B. 乙醇在浓硫酸催化下,170℃时脱水生成乙烯的反应为消去反应
C. 乙醇的核磁共振氢谱图上有3个吸收峰,其强度之比为3︰2︰1,与钠反应的是
吸收强度最小的氢原子
 D. 乙醇与甲醚互为官能团异构体
D. 乙醇与甲醚互为官能团异构体
(三)设计方案、进行实验
甲同学用4mL 95%的乙醇、8mL90%浓硫酸、
6g溴化钠研究乙醇转化为溴乙烷的反应。右图
是他设计的实验装置图(已省略部分夹持仪器)。
请回答有关问题。
(3)预计实验时装置Ⅰ主要发生两个反应,写出反应②的化学方程式。
![]() ①2NaBr + H2SO4 2HBr + Na2SO4,
①2NaBr + H2SO4 2HBr + Na2SO4,
②
(4)实验过程中,观察到反应后期烧瓶内液体颜色变棕黑,U形管右边与大气相通的导管口产生大量有刺激性气味的白雾,U形管内有少量淡黄色液体,该液体的有机成分是 。若要获得纯净的溴乙烷,方法是:实验结束后 。
(四)反思与改进
(5)乙同学认为:实验所用浓硫酸必须进行稀释,目的是 (填字母),稀释后的浓硫酸应放在 (填实验仪器名称)中。
A.减少HBr的挥发 B.防止浓硫酸分解产生SO2
C.减少副产物乙烯和乙醚的生成 D.减少Br2的生成
(6)丙同学提出应该对实验装置进行改进,请为两部分装置选择正确的措施:
A.不作改变 B.保留酒精灯加热,增加温度计且温度计水银球插入反应液中
C.水浴加热 D.冰水混合物冷却
装置Ⅰ ;装置Ⅱ 。请你再提出一条改进措施 。
过氧化尿素是一种无毒无味的白色粉末,是一种新型的漂白剂与消毒剂。它的合成方式如下:
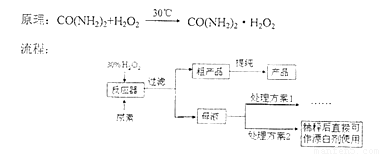
请回答下列问题:
(1)根据反应原理,CO(NH2)2·H2O2分子内存在的作用力
是 。
A.共价键 B.离子键
C.金属键 D.氢键
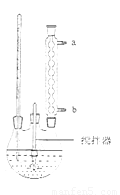
(2)流程图中反应器的装置如图所示,推测该反应的加热方式是 ;回流管中冷水流从 口流入;搅拌器选用的材质是玻璃而不是铁质或铝质材料的原因是 。
(3)母液处理方案1可以是 (用文字表达)。若欲从母液中离出H2O2和尿素,可采用的操作是 (选填序号)
A.盐析、过滤 B.减压蒸馏、结晶
C.分液、过滤 D.常压蒸馏、萃取
(4)为测定产品中活性氧的含量(活性氧16%,相当于H2O234%),称取干燥样品2.000g,溶解,在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL 6mol·L-1的硫酸,然后用0.1000mol·L-1 KMnO4标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液8.00mL(KMnO4溶液与尿素不反应)。
①完成并配平方程式: MnO4-+ H2O2+ H+= MnO2++ H2O+
②若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量 。(“偏高”、“偏低”或“不变”)。
③根据滴定结果,可确定产品中活性氧的质量分数为 。
过氧化尿素是一种无毒无味的白色粉末,是一种新型的漂白剂与消毒剂。它的合成方式如下:
请回答下列问题:
(1)根据反应原理,CO(NH2)2·H2O2分子内存在的作用力
是 。
A.共价键 B.离子键
C.金属键 D.氢键
(2)流程图中反应器的装置如图所示,推测该反应的加热方式是 ;回流管中冷水流从 口流入;搅拌器选用的材质是玻璃而不是铁质或铝质材料的原因是 。
(3)母液处理方案1可以是 (用文字表达)。若欲从母液中离出H2O2和尿素,可采用的操作是 (选填序号)
A.盐析、过滤 B.减压蒸馏、结晶
C.分液、过滤 D.常压蒸馏、萃取
(4)为测定产品中活性氧的含量(活性氧16%,相当于H2O234%),称取干燥样品2.000g,溶解,在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL 6mol·L-1的硫酸,然后用0.1000mol·L-1 KMnO4标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液8.00mL(KMnO4溶液与尿素不反应)。
①完成并配平方程式: MnO4-+ H2O2+ H+= MnO2++ H2O+
②若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量 。(“偏高”、“偏低”或“不变”)。
③根据滴定结果,可确定产品中活性氧的质量分数为 。
学校实验室现有含少量NaCl杂质的Na2CO3固体样品,某化学兴趣小组的同学决定测定样品Na2CO3的质量分数,甲、乙两位同学分别设计出下列两种实验方案:

(1)甲同学用图1所示装置,取1.0g的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积。实验开始时检查该装置气密性的方法是 ;注射器的容积至少是
A.100mL B.150mL C. 200mL D.250mL
如果注射器内的气体体积增大168mL(标准状况),那么样品的纯度是
(2)乙同学用图2装置测定CO2的质量,该装置存在明显缺陷,从而导致实验误差,请你分析其中使测定结果可能偏大的主要原因 (写一条即可);使测定结果可能偏小的主要原因 (写一条即可)。
(3)丙同学利用沉淀法设计出下列实验方案。请将实验步骤补充完整。并回答相关问题:
① ,加适量蒸馏水使之全部溶解;
②向所得溶液中加入过量的CaCl2溶液使之生成CaCO3沉淀;
③ ;④计算样品的质量分数。
在步骤②中确保加入的CaCl2溶液过量的方法是:
(18分)1.已知一般钾盐均为可溶性的强电解质。在某溶液中可发生下列反应: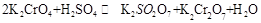
(1)试将上述反应改写成离子议程式
(2)该离子反应的平衡常数表达式为:K= ;
(3)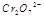 在水溶液中为红色,
在水溶液中为红色,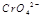 在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。
在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。
若加水将其稀释,溶液颜色将偏 (红、黄)原因是
;
若在在上述平衡体系的溶液中中加入硫酸钾固体体系颜色有何变化?为什么?
Ⅱ.固定和利用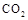 ,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用
,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用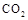 来生产甲醇燃料的方法,该方法的化学方程式是:
来生产甲醇燃料的方法,该方法的化学方程式是:
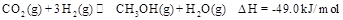
某科学实验将6mol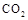 和8molH
和8molH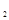 充入一容积为2L的密闭容器中,测得H
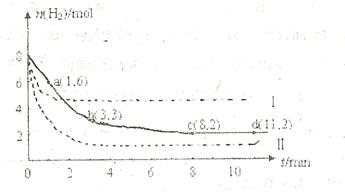
充入一容积为2L的密闭容器中,测得H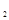 的物质的量随时间变化如右图中实线所示(图中字母后数字表示对应的坐标):
的物质的量随时间变化如右图中实线所示(图中字母后数字表示对应的坐标):
问题:
(1)由图分析,在下列时间段内反应速率最快的时间段是 (填答案编号)。
a.0~1min b.1~3min c.3~8min d.8~11min
(2)仅改变某一条件再进行实验,测得H 的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是
,曲线Ⅱ改变的条件可能是
的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是
,曲线Ⅱ改变的条件可能是
。
(3)下列表述能表示该反应已达平衡的是 (填答案编号)
a.容器内压强不再改变 b.容器内气体的密度不再改变
c.容器内气体平均摩尔质量不再改变 d.容器内各物质的物质的量相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com