
题目列表(包括答案和解析)
+ 3 |
2- 3 |
2- 4 |
+ 3 |
+ 3 |
2- 4 |
| A、燃料的燃烧反应都是放热反应 | B、绿色植物进行光合作用时,能把光能转化为化学能 | C、分子的热稳定性主要取决于分子内化学键的键能大小,与分子间作用力无关 | D、已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ?mol-1,则说明相同条件下,在密闭容器中,1 mol N2和3 mol H2混合充分反应后放热92.4 kJ |
 碳是形成化合物最多的元素.
碳是形成化合物最多的元素.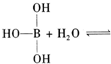

碳是形成化合物最多的元素。
(1)由碳元素参与形成的物质多为分子晶体,也有少数原子晶体。下列关于分子晶体和原子晶体的说法正确的是 (填字母序号)。
A、完全由非金属元素形成的物质一定是分子晶体或原子晶体
B、分子晶体中分子之间一定存在范德华力
C、SiC具有极高的熔点和较大的硬度,SiC分子中除存在共价键外,还存在分子间作用力
D、金刚石是由碳元素形成的原子晶体,性质稳定,不与任何物质反应
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如图所示。下列说法正确的是 。
A、C4属于一种新型的化合物 B、C4与P4(白磷)的晶体都属于分子晶体
C、C4气体分子内含有极性共价键 D、C4与C60互为同素异形
(3)与碳同主族元素锗为32号元素,与锗同周期,且未成对电子数与锗相同,电负性最大的元素的价电子排布式为 。
(4)邻硝基苯酚的熔点 对硝基苯酚(填“>”、“=”或“<”=)。
(5)硼、碳、氮、氧是元素周期表第二周期相邻的四种元素。下列有关的四种化合物中,键角最小的是 。
A、CO2 B、CF4 C、NF3 D、OF2
已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却是一元酸,可以用硼酸在水溶液中的电离平衡解释它是一元弱酸的原因。
请写出下面这个方程式右端的两种离子的表达式: 。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com