
题目列表(包括答案和解析)
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
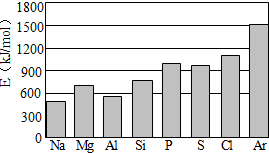 根据元素周期表及周期律的知识回答下列问题:
根据元素周期表及周期律的知识回答下列问题:| 一定条件 |
下列说法中,不正确的是
A.短周期元素中,最外层电子数是其电子层数两倍的元素共有3种
B.第三周期元素的离子半径大小比较:Cl->S2+>Na+>Mg2+>Al3+
C.日本福岛核电站释放出的放射性核素131I与132I、133I互为同位素
D.相同条件下,通过测定同浓度的Na2CO3溶液和Na2SO4溶液的pH,可比较C和S的非金属性强弱
下列说法中,不正确的是
A.短周期元素中,最外层电子数是其电子层数两倍的元素共有3种
B.第三周期元素的离子半径大小比较:Cl->S2+>Na+>Mg2+>Al3+
C.日本福岛核电站释放出的放射性核素131I与132I、133I互为同位素
D.相同条件下,通过测定同浓度的Na2CO3溶液和Na2SO4溶液的pH,可比较C和S的非金属性强弱
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com