
题目列表(包括答案和解析)
| ||
| ||
| ||
| △ |
| ||
| △ |
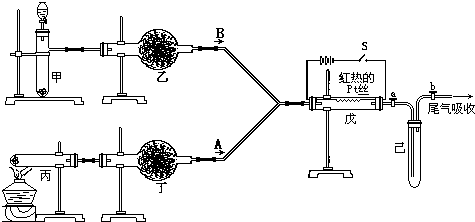
琉酸是无机“三大强酸"之一,其产量是衡量一个国家无机化工发展水平的重要标志。工业制硫酸的工艺流程如下图:

据图回答下列问题:
(1)写出用黄铁矿(主要含FeS2)造气的化学反应方程式________。
(2) 给出A、B物质的名称:A________, B________
(3) 催化氧化之前对SO2和空气的混合气体进行净化、干燥的目的是________ 选用B进入吸收塔吸收SO3的优点是________。
(4) SO2的催化氧化是一个可逆反应,采取适宜的反应条件有利于生产的进行。实际生产中,下列哪些生产条件或措施考虑到了平衡移动原理________ (选填序号)。
A.矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.催化反应室中选择400-5000C温度
D.净化后的炉气中要有过量的空气
E. 催化氧化在常压下进行
F. 将尾气中的SO2循环利用
(5) 某硫酸厂每天消耗黄铁矿石(含FeS2质量分動60%) 20吨,生产的三阶段的转化率依次为98%、95%、98%,则该工厂一天能生产B的质量为__________吨。
| ||
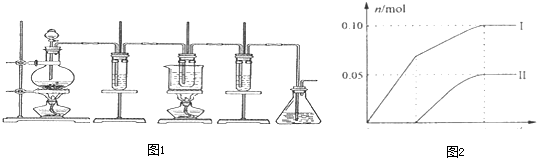
 某校甲、乙、丙三个化学兴趣小组利用课外活动时间,设计了不同的课题分别进行了实验探究活动:
某校甲、乙、丙三个化学兴趣小组利用课外活动时间,设计了不同的课题分别进行了实验探究活动: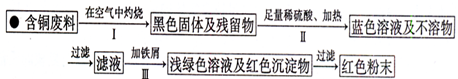

(1)甲小组进行中和滴定实验,实验室里提供了下面几种仪器:酸式滴定管、碱式滴定管、量筒、托盘天平、普通漏斗、玻璃棒、烧杯,你认为还缺少的玻璃仪器是__________。
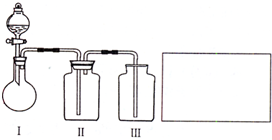
(2)乙小组设计了如下图所示的一套实验装置,以探究该装置的多功能性。

①李明同学认为该装置可以用来制取、收集SO2气体,其中Ⅲ中盛有NaOH溶液。乙小组同学经过讨论后认为该装置存在安全隐患,需要将Ⅲ进行改装,请将改装后的装置图画在方框内。
②王强同学认为可利用该装置快速制取、净化、收集氨气。其中Ⅱ中盛有浓硫酸。你认为是否正确,若正确则不需作答;若不正确,提出改进意见___________________。
(3)丙小组进入了一家回收含铜电缆废料的工厂做社会调查,技术员向同学们展示了两个处理方案,并向同学们提出下列问题:
方案1:

方案2:

①你认为方案___________________更符合当前绿色生产的理念。
②写出方案1中步骤Ⅱ反应的离子方程式__________________。
③技术员指出,无论是方案1还是方案2,都应加入稍过量的铁屑并最终除去,请你设计出去铁屑的操作方法______________________________________________________。
④为了增加经济效益,该工厂把最后一步所得浅绿色溶液,通过__________________、冷却结晶、过滤、洗涤、自然干燥得到一种俗称“绿矾”的工业产品。
⑤丙组同学经查询资料、研究、讨论,又设计了方案3,即把方案2中“加入足量稀硫酸、通入空气并加热”改为“加入足量稀硫酸和H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com