
题目列表(包括答案和解析)

(1)(19分)①研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,其中合理的是 (填序号)
| A.铁片置于硫酸铜溶液中有铜析出; |
| B.铁、铜与氯气反应分别生成FeCl3、CuCl2; |
| C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu=2FeCl2+ CuCl2) |
| D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡 |


 及电极均相同,两杯溶液的温度不同,可否形成原电池
及电极均相同,两杯溶液的温度不同,可否形成原电池| 甲杯硫酸铜浓度 mol/L | 0.8 | 0.8 | 0.8 | 0.8 | 0.8 | 0.8 |
| 乙杯硫酸铜浓度 mol/L | 0.8 | 0.4 | 0.2 | 0.1 | 0.05 | 0.025 |
| 两杯溶液浓度差值 | 0 | 0.4 | 0.6 | 0.7 | 0.75 | 0.775 |
| 电压 mV | 0 | 6 | 12 | 16 | 22 | 26 |
电流 mA mA | 0 | 0.02 | 0.04 | 0.06 | 0.07 | 0.08 |
| 甲杯硫酸铜温度℃ | 19 | 19 | 19 | 19 | 19 | 19 |
| 乙杯硫酸铜温度℃ | 19 | 29 | 39 | 49 | 59 | 69 |
| 两杯溶液温差℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 电压 mV | 0 | 6.1 | 12 | 20 | 27 | 34 |
| 电流 mA | 0 | 0.025 | 0.047 | 0.07 | 0.15 | 0.18 |
 面有铜析出。
面有铜析出。
(1)(19分)①研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,其中合理的是 (填序号)
A.铁片置于硫酸铜溶液中有铜析出;
B.铁、铜与氯气反应分别生成FeCl3、CuCl2;
C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu=2FeCl2+ CuCl2)
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡
E.常温下,分别将铁片和铜片置于浓硝酸中,铁片不溶解,而铜片溶解
②请你另设计一个能证明铁的金属活动性比铜强的实验。要求:
a.此方案的原理不同于上述任一合理方案;
b.在方框内绘出实验装置图并注明所需的药品;
c.写出实验过程中的主要实验现象并用相关化学用语解释现象

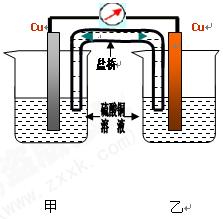
(2)学完原电池的相关知识后,甲组同学认为构成原电池必须有三个条件:①活动性不同的两极;②电解质溶液;③闭合回路。乙组同学对条件①提出异议,认为相同的两极也可以构成原电池,以下为乙组同学的实验装置简图以及实验报告的部分内容。请仔细阅读实验报告,然后将实验报告补充完整并填在相应的横线上。装置中盐桥的作用之一是使整个装置构成闭合回路。

浓差电池与温差电池
一、【实验目的】
1、电池中两杯溶液及电极均相同,两杯溶液的浓度不同,可否形成原电池
2、电池中两杯溶液及电极均相同,两杯溶液的温度不同,可否形成原电池
3、电池中两杯溶液及电极均相同,研究两杯溶液的 对电池电压和电流的影响
4、电池中两杯溶液及电极均相同,研究两杯溶液的 对电池电压和电流的影响
二、【仪器与药品】略。
三、【实验方法与步骤】
Ⅰ、实验方法:略。
Ⅱ、研究的步骤
㈠实验A:浓差电池
电解液均为硫酸铜,电极均为铜片:
1、甲烧杯中固定装入浓度 0.8 mol/L 的硫酸铜溶液。
2、乙烧杯中分別装入浓度 0.8 mol/L、0.4 mol/L 、0.2 mol/L、0.1 mol/L、0.05 mol/L、0.025 mol/L 的硫酸铜溶液。
3、使用铜片当电极。测量这六种组合电池的稳定电压及电流,将结果记录于表 1。
㈡实验B:温差电池
电解液均为硫酸铜,电极均为铜片:(步骤略,结果记录于表2)
四、【实验结果】
实验A:浓差电池 :表1
|
甲杯硫酸铜浓度 mol/L |
0.8 |
0.8 |
0.8 |
0.8 |
0.8 |
0.8 |
|
乙杯硫酸铜浓度 mol/L |
0.8 |
0.4 |
0.2 |
0.1 |
0.05 |
0.025 |
|
两杯溶液浓度差值 |
0 |
0.4 |
0.6 |
0.7 |
0.75 |
0.775 |
|
电压 mV |
0 |
6 |
12 |
16 |
22 |
26 |
|
电流 mA |
0 |
0.02 |
0.04 |
0.06 |
0.07 |
0.08 |
实验B:温差电池:表2
|
甲杯硫酸铜温度℃ |
19 |
19 |
19 |
19 |
19 |
19 |
|
乙杯硫酸铜温度℃ |
19 |
29 |
39 |
49 |
59 |
69 |
|
两杯溶液温差℃ |
0 |
10 |
20 |
30 |
40 |
50 |
|
电压 mV |
0 |
6.1 |
12 |
20[来源:] |
27 |
34 |
|
电流 mA |
0 |
0.025 |
0.047 |
0.07 |
0.15 |
0.18 |
五、【讨论】
1、浓差电池:若硫酸铜浓差电池放电较长一段时间后,可观察到甲杯高浓度的溶液颜色逐渐变浅,而乙杯颜色变深,而电压也逐渐下降,同时可观察到甲杯中铜片表面有铜析出。
这说明:甲杯中的电极反应式为
乙杯中的电极反应式为
电池放电一段较长时间后电压下降的原因:
2、温差电池(略)
六、【结论】
由上述【实验结果】可得结论:
实验A: [来源:学&科&网Z&X&X&K]
实验B:(略)
甲、乙两小组同学给你什么启示:
| A.铁片置于硫酸铜溶液中有铜析出; |
| B.铁、铜与氯气反应分别生成FeCl3、CuCl2; |
| C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu=2FeCl2+ CuCl2) |
| D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡 |
 及电极均相同,两杯溶液的温度不同,可否形成原电池
及电极均相同,两杯溶液的温度不同,可否形成原电池| 甲杯硫酸铜浓度 mol/L | 0.8 | 0.8 | 0.8 | 0.8 | 0.8 | 0.8 |
| 乙杯硫酸铜浓度 mol/L | 0.8 | 0.4 | 0.2 | 0.1 | 0.05 | 0.025 |
| 两杯溶液浓度差值 | 0 | 0.4 | 0.6 | 0.7 | 0.75 | 0.775 |
| 电压 mV | 0 | 6 | 12 | 16 | 22 | 26 |
电流 mA mA | 0 | 0.02 | 0.04 | 0.06 | 0.07 | 0.08 |
| 甲杯硫酸铜温度℃ | 19 | 19 | 19 | 19 | 19 | 19 |
| 乙杯硫酸铜温度℃ | 19 | 29 | 39 | 49 | 59 | 69 |
| 两杯溶液温差℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 电压 mV | 0 | 6.1 | 12 | 20 | 27 | 34 |
| 电流 mA | 0 | 0.025 | 0.047 | 0.07 | 0.15 | 0.18 |
 面有铜析出。
面有铜析出。
太阳是银河系中极为普通的一颗恒星,剧烈的热核反应使之不断地向外辐射能量。太阳辐射的能量绝大部分集中在紫外波段,可见光波段和红外光波段,它们的能量分别占总辐射量的9%、44%和47%。地球的大气层中,基本不变的成分为氧、氮、氩等,占大气总量的99.96%,可变气体成分主要有CO2、水汽和臭氧等,这些气体的含量极小,但对大气物理状况的影响极大。大气臭氧层一般是指高度在离地面10~15Km的大气层,其中臭氧的浓度很低,将它折合成标准状况,其总累积厚度也不过0.3cm,其含量虽小,但对地球的气候和生物影响很大。
(1)大气压强P随距地面高度Z(m)的增大而减小,经验公式为PZ=![]() ,其中P0为地表的气压值,e=2.718。若臭氧层集中在24km的高空处,设在该高度处的温度为—50℃。试估算臭氧层的厚度。
,其中P0为地表的气压值,e=2.718。若臭氧层集中在24km的高空处,设在该高度处的温度为—50℃。试估算臭氧层的厚度。
(2)简要说明臭氧层对地球生物圈的意义。
![]() (3)臭氧层的生消可以简化成如下的反应方程:高层大气中的一个重要的光化学反应是氧分子吸收太阳辐射中波长λ<0.24μm的光子,离解为氧原子,即O2+hν(λ<0.24μm) O+O,由此可形成一系列的反应,其中最重要的是氧原子和氧分子在第三体(M)的参与下形成臭氧,其反应方程式为 。这里的M主要是氧分子或氮分子,它们是在反应过程中同时满足能量守恒和动量守恒所必须的。臭氧在λ<0.18μm的辐射作用下,能离解成氧分子和氧原子,其反应方程式为 。
(3)臭氧层的生消可以简化成如下的反应方程:高层大气中的一个重要的光化学反应是氧分子吸收太阳辐射中波长λ<0.24μm的光子,离解为氧原子,即O2+hν(λ<0.24μm) O+O,由此可形成一系列的反应,其中最重要的是氧原子和氧分子在第三体(M)的参与下形成臭氧,其反应方程式为 。这里的M主要是氧分子或氮分子,它们是在反应过程中同时满足能量守恒和动量守恒所必须的。臭氧在λ<0.18μm的辐射作用下,能离解成氧分子和氧原子,其反应方程式为 。
(4)人类的活动所产生的一些气体,能对大气中的臭氧起到破坏作用。使其含量减少,将造成严重后果,直接威胁到人类的生活和生存。近些年来,屡有在南极或北极,甚至在西藏出现臭氧空洞的报道,引起人们极大的关注。简要说明人类活动产生的那些气体对大气臭氧层能起破坏作用。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com