
题目列表(包括答案和解析)
| ||
| ||




| ||
| ||
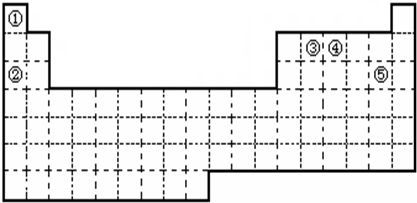
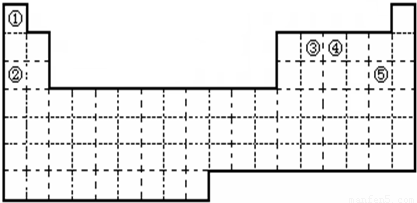
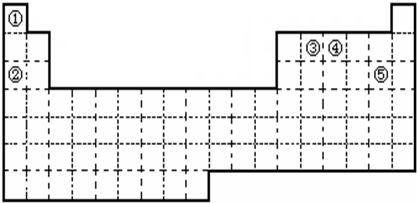
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小
②A、D同主族,A是所有元素中原子半径最小的元素
③B、D、E三者的最高价氧化物的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和
请填写下列空白:
(1)A
(2)单质F与足量乙的溶液反应的离子方程式为___________,1 mol单质E与乙溶液完全反应时,产生__________mol A2气体。
(3)写出乙+丙在溶液中反应的离子方程式___________________________________________。
(4)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为:______________________________________________________________。
(5)以石墨为电极,电解乙的溶液




湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com