
题目列表(包括答案和解析)
 研究金属的冶炼对人类有重要意义.
研究金属的冶炼对人类有重要意义.(11分)研究金属的冶炼对人类有重要意义。
(1)人类历史上大量生产和使用铝、铁、钛、铜四种金属单质的时间顺序是____________。
(2)铜的冶炼中有一步是2CuFeS2+4O2=Cu2S+3SO2+2FeO,反应的氧化产物是 。
 (3)右图是部分金属氧化物被一氧化碳还原时lg[p(CO)/p(CO2)]与温度的关系曲线图。则四种金属氧化物中最易被还原的金属氧化物是 ,该反应的△H 0。
(3)右图是部分金属氧化物被一氧化碳还原时lg[p(CO)/p(CO2)]与温度的关系曲线图。则四种金属氧化物中最易被还原的金属氧化物是 ,该反应的△H 0。
(4)下列说法正确是
A.氧化镁跟铝粉共热适于炼镁
B.不锈钢含有金属和非金属元素
C.所有金属均以化合物存在于自然界
D.金属冶炼中还原剂可以是一些活泼金属
E.活泼金属的冶炼都是通过电解其盐溶液制得
F.金属提炼一般要经过矿石的富集、冶炼、精炼三步
(5)为测定某一铁矿石样品中的铁元素的质量分数, 取3.702g该铁矿石(铁以Fe2O3形式存在,其余物质不含铁)溶于浓热盐酸中,稀释至250mL,从中取出25mL溶液,作如下处理:加入过量的氨水,使铁以氢氧化铁的形式沉淀,将沉淀过滤,洗净并灼烧,使之完全转化为氧化铁。有关实验数据:坩埚质量:15.2861g,三次灼烧后坩埚和固体的质量:15.6209g、15.6205g、15.6205g 。则铁矿石中的铁元素的质量分数为__________________(百分数中的数字保留到小数点后一位)。
| 现 象 | |
| 铝与氧化铁反应的化学方程式 |
| 观点 | 是否正确 | 简述理由 |
| 学生1 | 否 | ______ |
| 学生2 | ______ | ______ |
| 学生3 | ______ | ______ |
| △ |
| 电解 |
| 2800℃ |
| △ |
| C真空 |
| 1352℃ |
| ①过量盐酸 |
| ②△ |
| 电解 |
| 714℃ |
| 盐酸 |
| 活泼金属 |
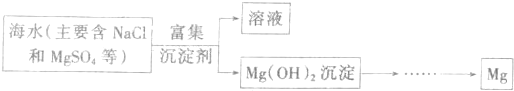
冶炼金属常用以下几种方法:①以C、CO或H2做还原剂 ②以活泼金属Na、Mg等还原 ③利用铝热反应原理还原 ④电解法 ⑤热分解法。下列金属各采用哪种方法还原最佳。(用序号填写下列空白)。
(1)Fe、Zn、Cu等中等活泼金属 。
(2)Na、Mg、Al等活泼或较活泼金属 。
(3)Hg、Ag等不活泼金属 。
(4)V、Cr、Mn、W等高熔点金属 。
II(共6分).从A.乙烯 B.乙酸 C.葡萄糖 D.纤维素 E.油脂 F.蛋白质六种有机物中选择合适的物质,将其字母序号填在空格内。
(1)属于烃类的是 。
(2)能与乙醇发生酯化反应的是 。
(3)植物通过光合作用直接生成的有机物是 。
(4)肉、蛋、奶等富含 。
(5)能作为制造肥皂的原料是 。
(6)棉花、甘蔗渣的主要成分是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com