
题目列表(包括答案和解析)
 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是非通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是非通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是


| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ?mol-1 | 197 | 360 | 499 | X |

| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ?mol-1 | 198 | 360 | 498 | X |
 20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.分析图中信息,回答下列问题:
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.分析图中信息,回答下列问题: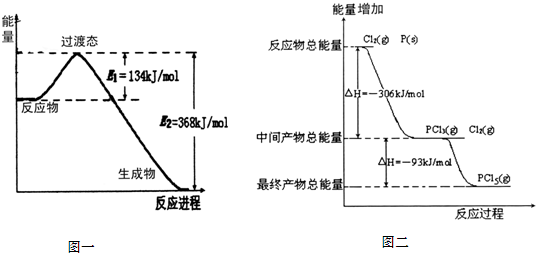
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com