
题目列表(包括答案和解析)
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)

已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 go。

实验流程:
①往装置A中加入2.7mL (2.3 g)甲苯和125 mL水,然后分批次加入8.5 g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热。
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品。
③纯度测定:称取1.220g白色样品,配成100mL、甲醇溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示列举

请回答:
(1)装置A的名称????????? 。若不用温度计,本实验控制反应温度的措施为?????????? 。
(2)白色粗产品中除了KCl外,其他可能的无机杂质为____???????????? 。
(3)操作I的名称?????????????????????????????????? 。
(4)步骤③中用到的定量仪器有?????????????? ,100mL容量瓶,50mL酸式、碱式滴定管。
(5)样品中苯甲酸纯度为??????????????????????????? 。
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果??? (填“偏大”、“偏小”或“不变”)。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | --- |

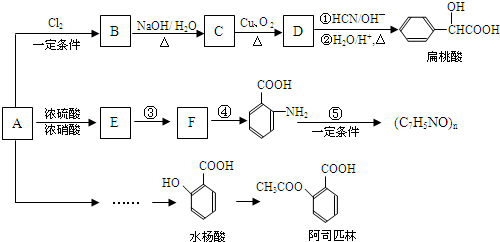
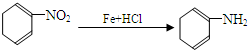 (苯胺,易被氧化)
(苯胺,易被氧化) (X为Cl或Br)
(X为Cl或Br)

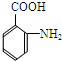
| 一定条件 |
 +(n-1)H2O
+(n-1)H2O
| 一定条件 |
 +(n-1)H2O
+(n-1)H2O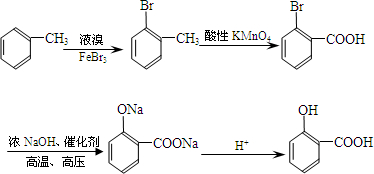


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com