
题目列表(包括答案和解析)
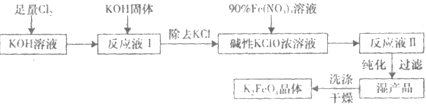
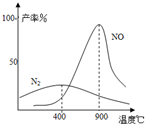 (2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下:
(2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下: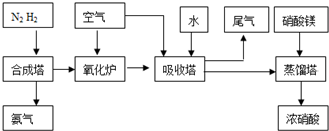
| 时间(h)浓度(mol/L) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.500 | 1.400 | 1.200 | C1 | C1 |
| H2 | 4.500 | 4.200 | 3.600 | C2 | C2 |
| NH3 | 0 | 0.200 | 0.600 | C3 | C3 |
| 1 |
| a |
| 1 |
| a |
| 观察要点或实验步骤 | 现象、结论或注意事项 | |
| 方法一 | 观察二者外观上的细小差别 | 呈 白色粉末 白色粉末 状的是碳酸钠,呈白色细小晶体 白色细小晶体 的是碳酸氢钠 |
| 方法二 | 分别滴入几滴水 | 结成块状并且试管底部温度较高的是 碳酸钠 碳酸钠 ;未结块并且试管底部温度较低的是 碳酸氢钠 碳酸氢钠 . |
| 方法三 | 再分别加入10mL水,滴入 1~2滴酚酞试液 |
该操作中加入水后应 用力振荡或用玻璃棒搅拌 用力振荡或用玻璃棒搅拌 ;滴入酚酞后应着重观察 所得溶液颜色的深浅 所得溶液颜色的深浅 . |

| ||
| ||

| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com