
题目列表(包括答案和解析)
某研究组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是
A.该装置为原电池,通入O2的电极是负极
B.该装置中,通入SO2的电极的电极反应式为:SO2+O2-+H2O -2e-=2H++SO42-
C.该装置中,H+通过质子膜向左侧移动
D.在标准状况下,理论上每消耗11.2L SO2,则可产生0.5mol H2SO4
【解析】氧气是得电子得,所以氧气在正极通入。SO2在反应中失去电子,在负极通入,所失去得电子经导线传递到正极上,所以溶液中得阳离子向正极移动。因为交换膜只允许氢离子通过,所以负极得电极反应式为SO2+2H2O -2e-=4H++SO42-。所以正确的答案是D。
下面关于原电池的说法,正确的是( )
A.在正极上发生氧化反应 B.化学性质较活泼的一极为负极
C.在外电路中电子流出的极为正极 D.原电池是将电能转化为化学能的装置
【解析】在原电池中较活泼的金属作负极,失去电子,被氧化,发生氧化反应。所失去的电子经导线传递到正极,因此正极得到电子,被还原,发生还原反应。所以原电池是把化学能转化为电能的装置。答案选B。
某研究组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是
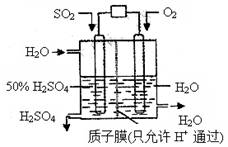
A.该装置为原电池,通入O2的电极是负极
B.该装置中,通入SO2的电极的电极反应式为:SO2+O2-+H2O -2e- =2H++SO42-
C.该装置中,H+通过质子膜向左侧移动
D.在标准状况下,理论上每消耗11.2L SO2,则可产生0.5mol H2SO4
【解析】氧气是得电子得,所以氧气在正极通入。SO2在反应中失去电子,在负极通入,所失去得电子经导线传递到正极上,所以溶液中得阳离子向正极移动。因为交换膜只允许氢离子通过,所以负极得电极反应式为SO2+2H2O -2e-=4H++SO42-。所以正确的答案是D。
下面关于原电池的说法,正确的是( )
A.在正极上发生氧化反应 B.化学性质较活泼的一极为负极
C.在外电路中电子流出的极为正极 D.原电池是将电能转化为化学能的装置
【解析】在原电池中较活泼的金属作负极,失去电子,被氧化,发生氧化反应。所失去的电子经导线传递到正极,因此正极得到电子,被还原,发生还原反应。所以原电池是把化学能转化为电能的装置。答案选B。
(8分)某研究小组探究SO2和Fe(NO3)3溶液的反应。

已知: 1.0 mol/L的Fe(NO3)3溶液中c(H+)=0.01mol/L
请回答:
(1)装置A中反应的化学方程式是 。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是 。
(3)装置B中产生了白色沉淀,其成分是 ,说明SO2具有 性。
(4)分析B中产生上述白色沉淀的原因可能是:
观点1: ;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①如果观点2正确,装置B中反应的离子方程式是
②如果想验证观点3,只需将装置B中的 Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是(填序号) 。
a.0.1 mol/L 稀硝酸
b.1.5 mol/L Fe(NO3)2溶液
c.6.0 mol/L NaNO3和0.02 mol/L盐酸等体积混合的溶液
【解析】(1)装置A是原来制取SO2的,所以方程式为Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O。
(2)可以通过通入氮气来排尽装置中的空气。
(3)硝酸铁溶液显酸性,因此生成的沉淀只能是硫酸钡沉淀,这说明SO2被硝酸铁氧化生成了硫酸,从而产生硫酸钡白色沉淀,因此SO2具有还原性。
(4)因为铁离子和硝酸跟离子均能氧化SO2,所以SO2被氧化生成硫酸,既可能是被铁离子氧化,也可能是被酸性条件下的硝酸跟离子氧化,后者是同时被氧化。要想验证观点③,就必须排除铁离子和硝酸的干扰, a是硝酸能直接氧化SO2,由于SO2溶于水显酸性,因此硝酸亚铁在酸性溶液中,亚铁离子可被硝酸氧化生成铁离子。因此答案选择c。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com