
题目列表(包括答案和解析)
| 点燃 |
| 点燃 |
| 点燃 |
| 点燃 |
| 点燃 |
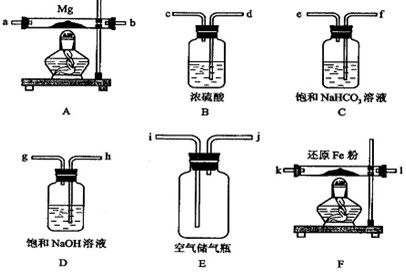
| △ |
| △ |
镁是很活泼的金属,常用做脱硫剂,脱氧剂。在电子工艺中利用镁制取硅的反应为:2Mg+ SiO2![]() 2MgO+Si,△H=-372kJ•mol-1,同时有副反应:2Mg+Si
2MgO+Si,△H=-372kJ•mol-1,同时有副反应:2Mg+Si![]() Mg2Si发生。Mg2Si遇盐酸迅速反应生成硅烷(SiH4),SiH4常温下是一种不稳定,易分解的气体。
Mg2Si发生。Mg2Si遇盐酸迅速反应生成硅烷(SiH4),SiH4常温下是一种不稳定,易分解的气体。

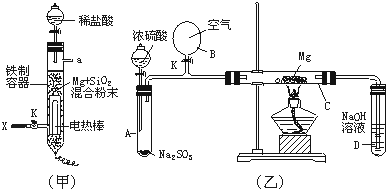
甲 乙
(1)如图甲所示是进行Mg与SiO2反应的实验装置。
①由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气。X气体应为________(镇标号)。
A.H2 B.N2 C.CO2
②实验开始时必须先通入X气体后,再接通电源加热反应物,其理由是________,当反应引发后,切断电源,反应能继续进行,其理由是________
③反应结束后,待冷却至常温后,关闭K,从分液漏斗处加稀盐酸,可观察到导管口A处有闪亮的火星,据此可推知SiH4的性质________。
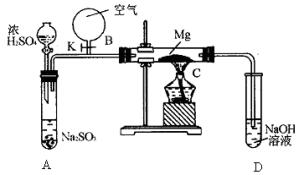
(2)用图乙所示装置的实验如下:先关闭K,使A中反应进行,加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。实验完成后将C管中固体全部加入盐酸中,有腐蛋味气体生成。
①C中Mg应放在不锈钢垫片上,而不能直接接触试管壁,这是因为________。
②停止实验时,先打开K,再停止滴加浓H2SO4,最后熄灭酒精灯。橡胶气胆B在实验中的作用是________。
③C中全部产物有________(填化学式)。


甲 乙
(1)如图甲所示是进行Mg与SiO2反应的实验装置。
①由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气。X气体应为________(镇标号)。
A.H2 B.N2 C.CO2
②实验开始时必须先通入X气体后,再接通电源加热反应物,其理由是________,当反应引发后,切断电源,反应能继续进行,其理由是________
③反应结束后,待冷却至常温后,关闭K,从分液漏斗处加稀盐酸,可观察到导管口A处有闪亮的火星,据此可推知SiH4的性质________。
(2)用图乙所示装置的实验如下:先关闭K,使A中反应进行,加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。实验完成后将C管中固体全部加入盐酸中,有腐蛋味气体生成。
①C中Mg应放在不锈钢垫片上,而不能直接接触试管壁,这是因为________。
②停止实验时,先打开K,再停止滴加浓H2SO4,最后熄灭酒精灯。橡胶气胆B在实验中的作用是________。
③C中全部产物有________(填化学式)。

| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com