
题目列表(包括答案和解析)

 CH3OH(g)△H
CH3OH(g)△H| 温度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
| V2 |
| a2 |
| V2 |
| a2 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2moL H2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 的 数 据 |
CH3OH浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
| 时间/s 浓度mol?L-1 |
0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)mol?L-1 | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2)/mol?L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
(2011?大兴区二模)常温下,将不同浓度的氨水与盐酸等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,则下列说法不正确的是
|
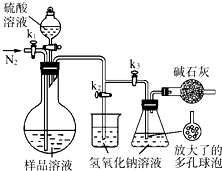 (2013?江苏三模)碳酸钠-过氧化氢加合物(aNa2CO3?bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:
(2013?江苏三模)碳酸钠-过氧化氢加合物(aNa2CO3?bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:高三化学
第I卷(选择题,共48分)
一.选择题(本题包括24小题,每小题2分,共48分。每小题只有一个选项符合题意。)
题号
1
2
3
4
5
6
7
8
9
10
答案
C
C
D
B
C
D
C
A
C
B
题号
11
12
13
14
15
16
17
18
19
20
答案
D
C
B
A
C
D
C
B
A
A
题号
21
22
23
24
答案
B
B
C
D
第II卷(共52分)
二.简答题(本大题包括5小题,共45分。)
【考生注意】第25题分A、B两题,考生可任选一题。若两题均做,一律按A题计分。
25.(A题,8分)(1)画出金属元素与非金属元素的分界线(2分)
Na
Cl
(2) IVA 族。(1分,其他答案均不给分)
(3)①见表中“Na”和“Cl”(各1分,写成名称或位置写错均不给分)。
② 氯 (填名称,1分),化学反应方程式 Cl2+H2S=2HCl+S(2分,其他合理答案也给分) 。
25.(B题,8分)
Mg
Al
|