
题目列表(包括答案和解析)
共11分)2005年1月美国科学家在Science上发表论文,宣布发现了Al的超原子结构,并预言其他金属原子也可能存在类似的结构,这是一项将对化学、物理以及材料领域产生重大影响的发现,引起了科学界的广泛关注。这种超原子是在Al的碘化物中发现的,以13个Al原子或14个Al原子形成Al13或Al14超原子结构,量子化学计算结果表明,Al13形成12个Al在表面,1个Al在中心的三角二十面体结构,Al14可以看作是一个Al原子跟Al13面上的一个三角形的3个Al形成Al―Al键而获得的。文章还指出,All3和All4超原子都是具有40个价电子时最稳定。
(1) 根据以上信息可预测Al13和Al14的稳定化合价态分别为 和 。A114应具有元素周期表中 类化学元素的性质,理由是: 。
(2) 对Al13和A114的Al―Al键长的测定十分困难,而理论计算表明,Al13,和Al14中的Al―Al键长与金属铝的Al―Al键长相当,已知金属铝的晶体结构采取面心立方最密堆积,密度约为2.7g/cm3,请估算Al13和Al14:中Al―Al的键长。
。
(3) Al13三角二十面体中有多少个四面体空隙,假设为正四面体空隙,如果在其中搀杂其他原子,请通过计算估计可搀杂原子的半径最大为多少?
序号 | 内容 | 实验现象 |
1 | 常温下将铁丝放在干燥空气中一个月 | 干燥的铁丝表面依然光亮 |
2 | 常温下将铁丝放在潮湿空气中一小时 | 铁丝表面依然光亮 |
3 | 常温下将铁丝放在潮湿的空气中一个月 | 铁丝表面已变得灰暗 |
4 | 将潮湿的铁丝放在常温的氧气流中一小时 | 铁丝表面略显灰暗 |
5 | 将潮湿的铁丝放在高于常温的氧气流中一小时 | 铁丝表面已变得灰暗 |
6 | 将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 | 铁丝表面灰暗程度比实验5严重 |
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号) __________; 在电化学腐 蚀中,负极反应是________________; 正极反应是_______________________;
(2)由该实验可知,可以影响铁锈蚀速率的因素是_________________________;
(3)为防止铁的锈蚀,工业上普遍采用的方法是______________(答两种方法)
(08年海南卷)(11分)如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
序号 | 内容 | 实验现象 |
1 | 常温下将铁丝放在干燥空气中一个月 | 干燥的铁丝表面依然光亮 |
2 | 常温下将铁丝放在潮湿空气中一小时 | 铁丝表面依然光亮 |
3 | 常温下将铁丝放在潮湿的空气中一个月 | 铁丝表面已变得灰暗 |
4 | 将潮湿的铁丝放在常温的氧气流中一小时 | 铁丝表面略显灰暗 |
5 | 将潮湿的铁丝放在高于常温的氧气流中一小时 | 铁丝表面已变得灰暗 |
6 | 将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 | 铁丝表面灰暗程度比实验5严重 |
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号) __________; 在电化学腐蚀中,负极反应是________________; 正极反应是_______________________;
(2)由该实验可知,可以影响铁锈蚀速率的因素是_________________________;
(3)为防止铁的锈蚀,工业上普遍采用的方法是______________(答两种方法)
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是_____、_______杂化轨道分别是________、_________;a分子的立体结构是____________。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是_______晶体、_______晶体:
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)__________;
(4)Y与Z比较,电负性较大的____________, 其+2价离子的核外电子排布式是_________。
该题是否有问题?题干中提到了W,但问题中并未涉及。
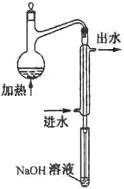
(08年江苏卷)(10分)金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN -和金属离子的配离子M(CN)nm-的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
①水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收。
②滴定:将吸收液调节至pH>11,以试银灵作指示剂,用AgNO3标准溶液滴定
 Ag++2CN - == [Ag(CN)2] -
Ag++2CN - == [Ag(CN)2] -
终点时,溶液由黄色变成橙红色。
根据以上知识回答下列问题:
⑴水样预处理的目的是 。
⑵水样预处理的装置如右图,细导管插入吸收液中是为了 ____
⑶蒸馏瓶比吸收液面要高出很多,其目的是 。
⑷如果用盐酸代替磷酸进行预处理,实验结果将 (填“偏高”、“无影响”或“偏低”)。
⑸准确移取某工厂污水100mL,经处理后用浓度为0.01000mol?L-1的硝酸银标准溶液滴定,终点时消耗了21.00mL。此水样中含氰化合物的含量为 mg?L-1的(以计,计算结果保留一位小数)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com