
题目列表(包括答案和解析)
| (w2-w1)×112×10 |
| 160a |
| (w2-w1)×112×10 |
| 160a |

| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称量a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水使反应完全;
④ 趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦ 重复以上操作,至最后两次称得的质量不超过0.1g为止。
请根据上面叙述,回答:
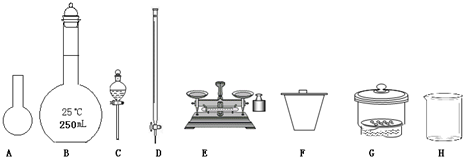
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E、F和 (填字母)。

(2)步骤②加入盐酸的目的是 ;加快样品溶解的最简单操作是 。
(3)写出步骤③中发生反应的离子方程式 。
(4)步骤⑤的洗涤是洗去附着在沉淀上的 (写离子符号),洗涤沉淀的操作 。
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为 。
(14分)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称取a g样品,置于烧杯中;
② 加适量盐酸和适量蒸馏水使样品溶解,准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
 ⑦……。
⑦……。
请根据上面叙述,回答:
(1)上图仪器中,实验步骤①②③中必须用到的仪器是E和
(填仪器序号)
(2)写出步骤③中发生反应的离子方程式
(3)步骤④中如何证明沉淀已完全?
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是
(5)若坩埚质量是W1 g,最终坩埚和固体的总质量是W2 g,则样品中铁元素的质量分数为 ________________________。
某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称量a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水使反应完全;
④ 趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦ 重复以上操作,至最后两次称得的质量不超过0.1g为止。
请根据上面叙述,回答:
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E、F和 (填字母)。
(2)步骤②加入盐酸的目的是 ;加快样品溶解的最简单操作是 。
(3)写出步骤③中发生反应的离子方程式 。
(4)步骤⑤的洗涤是洗去附着在沉淀上的 (写离子符号),洗涤沉淀的操作 。
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为 。
1.B 2.B 3.B 4.D 5.D 6.C 7.B 8.D 9.C 10.B
11.B 12.D 13.A 14.C 15.D 16.D 17.B 18.C 19.C 20.A
21.(8分)(1)取少量氨水,滴加酚酞试液,溶液呈红色,然后向其中加入少量CH3COONH4晶体,振荡,可看到红色变浅,说明氨水中存在电离平衡,说明氨水是弱碱。
(2)取少量NH4Cl晶体溶于水,滴加石蕊试液,溶液呈红色,说明NH4+水解,破坏了水的电离平衡,说明氨水是弱碱。(每小题4分)
22.(12分)(1)将等质量的氯酸钾分别加入两支试管中,向其中一支试管中加人少量一定质量的二氧化锰,用酒精灯分别加热,用排水法收集产生的气体。根据收集的氧气多少,可判断反应速率。
(2)用水溶解反应后的混合物,过滤并洗涤沉淀,干燥后称量,与最初加入量比较,可证明质量是否变化。
(3)将上述不溶物与浓盐酸混合加热,检验是否有氯气生成,可证明二氧化锰化学性质是否发生变化。
(4)将收集的气体用带火星的木条检验,可证明氯酸钾含氧元素。
(5)将(2)步骤作的滤液做焰色反应,可证明氯酸钾中是否含钾元素。
(6)将(2)步操作的滤液中加入用硝酸酸化的硝酸银溶液可证明氯酸钾中是否含氯元素。
(每步2分)
 25.(12分)(1)④③⑥ (2)G接F E接J(每空3分)
25.(12分)(1)④③⑥ (2)G接F E接J(每空3分)
(3)先向试管中加入一定量的稀H2SO4,(能没过锌片),将试管倾斜,小心地将锌片贴在试管壁上,塞好胶塞,连好装置,再将试管直立,使锌与稀H2SO4反应。(3分)
(4)设收集H2 VmL(标准状况),Zn的原子量为x
H2SO4+Zn=ZnSO4+H2↑
x 22.4L
W V×10-3L
x=  (3分)
(3分)
26.(8分)(1)C F G (2分)
(2)2Fe2+ +Cl2=2Fe3++2Cl- (2分)
(3)向漏斗里注入蒸馏水,使水面没过滤渣,等水自然流完后,重复操作2~3次。(2分)
(4)继续加热,放置干燥器中冷却,称量,至最后两次称得的质量差不超过 (2分)
(2分)
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com