
题目列表(包括答案和解析)
②甲基橙试液 ③蒸馏水 ④pH试纸 ⑤BaCl2溶液?⑥0.1 mol·?L-1 Na2S2O3溶液,试用两种简便方法将这两种不同浓度的硫酸溶液区分开: 。?
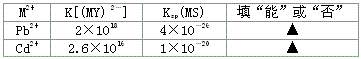


 (2011?肇庆二模)二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
(2011?肇庆二模)二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.| 物 质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol?L-1 | 0.01 | 0.2 | 0.2 |

| A、图1表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol?L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 | B、图2表示Cl2通入SO2溶液中pH的变化 | C、图3表示10 mL 0.01 mol?L-1KMnO4 酸性溶液与过量的0.1 mol?L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用) | D、图4表示已达平衡的某可逆反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com