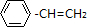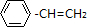I.已知:

,如果要合成
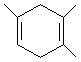
,所用的原料可以是
AD
AD
A.2-甲基-l,3-丁二烯和2-丁炔 B.1,3-戊二烯和2-丁炔
C.2,3-二甲基-1,3-戊二烯和乙炔 D.2,3-二甲基-l,3-丁二烯和丙炔
II.(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出C
6H
6的一种含叁键且无双键、无支链的链烃的结构简式
HC≡C-C≡C-CH2-CH3
HC≡C-C≡C-CH2-CH3
;
(2)苯不能使溴水褪色,性质类似烷烃,写出苯的硝化反应的化学方程式
;
(3)1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实(填入编号)
ad
ad
a.苯不能使溴水褪色 b.苯能与H
2发生加成反应 c.溴苯没有同分异构体 d.邻二溴苯只有一种
(4)苯分子的空间构型为
平面正六边形
平面正六边形
;现代化学认为苯分子碳碳之间的键是
介于单键和双键之间的独特的键
介于单键和双键之间的独特的键
.
Ⅲ.0.1mol某烃完全燃烧生成0.4mol H
2O,又知其含碳量为92.307%,则此有机物的分子式为
C8H8
C8H8
.若它是能聚合成高分子化合物的芳香族化合物,其结构简式为
;若其不能与氢气发生加成反应,且每个碳原子与另外三个碳原子相连接,键角为90度,则其结构式为
(用键线式表示),它的一氯代物有
1
1
种,二氯代物有
3
3
种.

 (2008?南京二模)(1)土壤的pH一般在4~9之间.土壤中Na2CO3含量较高时,pH可以高达10.5,
(2008?南京二模)(1)土壤的pH一般在4~9之间.土壤中Na2CO3含量较高时,pH可以高达10.5, HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O H2CO3+OH-
H2CO3+OH- HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O H2CO3+OH-
H2CO3+OH-
 【物质结构与性质】
【物质结构与性质】 某实验小组为确定过氧化氢分解的最佳催化条件,用如图实验装置进行实验,反应物用量和反应停止的时间数据如下:
某实验小组为确定过氧化氢分解的最佳催化条件,用如图实验装置进行实验,反应物用量和反应停止的时间数据如下: I.已知:
I.已知: ,如果要合成
,如果要合成 ,所用的原料可以是
,所用的原料可以是