
题目列表(包括答案和解析)
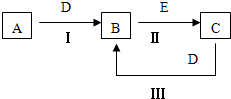 A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示.
A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示.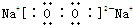
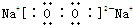
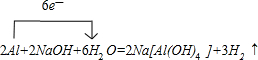
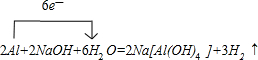
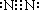
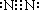
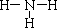
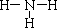
| 催化剂 |
| 高温、高压 |
| 催化剂 |
| 高温、高压 |

选择题
1―13 CBDCC CADDC CAB
14.A 15.C 16.AC 17.BD 18.C 19.ACD 20.ACD 21.C
22.I(1)AB
(2)m1>m2
(3)
(4)
I(1)A2, R1, A图
 (2)
(2)
评分细则:每空2分,实物连线4分,共18分。
23.(1)A匀速下滑时:
 ………………①
………………①
 ……………………②
……………………②
 ……………………③
……………………③
得: ………………④
………………④
(2)B沿斜面向下匀加速时:
 ………………⑤
………………⑤
 ……………………⑥
……………………⑥
对 ……………………⑦
……………………⑦
得: ……………………⑧
……………………⑧
评分细则:①②③共4分,直接写 也给4分,④4分,⑤⑥⑦⑧各2分,共16分。
也给4分,④4分,⑤⑥⑦⑧各2分,共16分。
24.解:(1)由楞次定律(或右手定则),
线框中感应电流的方向为逆时针(或abcda)………………①
(2) ……………………②
……………………②
 ……………………③
……………………③
 ……………………④
……………………④
 …………………………⑤
…………………………⑤
得: …………………………⑥
…………………………⑥
(3)由图可知,t=5.0s时,I=
 ……………………⑧
……………………⑧
 …………………………⑨
…………………………⑨
 …………………………⑩
…………………………⑩
由能量守恒: ……………………11
……………………11
得Q=1.75J……………………12
评分细则:①②各2分,③④⑤共4分,⑥2分,⑦⑧⑨⑩共4分,1112各2分,没有⑨但有其他相应过程也给1分,共18分。
25.(1),是动能定理: ……………………①
……………………①
 ………………②
………………②
得:v1=
(2)由动量定理: …………………………④
…………………………④
得: ……………………⑤
……………………⑤
在t1内传送带位移: ……………………⑥
……………………⑥
克服摩擦做功: ……………………⑦
……………………⑦
(3)对工件:从v2减到v1的过程中
 ……………………⑧
……………………⑧
得: ……………………⑨
……………………⑨
 ……………………⑩
……………………⑩
得: ……………………11
……………………11
匀速时间: ……………………12
……………………12
相邻两个工件间的时间间隔: ……………………13
……………………13
每分钟传送个数: 个……………………14
个……………………14
评分细则:①4分、②③各1分,④⑦各2分,⑤⑥各1分,⑧⑨⑩111213各1分,14各2分,共20分
26.(13分)
(1) 2分
2分
(2)H2O2,消毒剂(火箭燃料,脱氧剂,生产过氧化物的原料)(2×2分)
(3)NH4HCO5=NH3↑+H2O+CO2↑ (3分)
(4)(1分)大部分NH3与H2O结合生成NH3?H2O,可以部分电离成NH4+和OH―(3分)
27.(18分)
(1)AgNO3,HC1(2×1分)
混合时只生成一种沉淀的是KC1,生成的AgC1,所以D是AgNO3,H是KC1―(3分)
(2)Fe2(SO4)3+3Ba(OH)2=3BaSO4↓+2Fe(OH)3↓
(3)
(4)无明显变化,生成白色沉淀 (2×2分)
Ba2++OH-+HCO3-=BaCO3↓+H2O(3分)
28.(12分)
(1)①CH3CH2OH ②CH3OCH3 (2×1分)
(2)恢复至室温;调整导管与量筒内液面相平。(2分)
(3) (1分)

两次测定数值的平均值V(H2)=
由于0.100molC2H6O与适量Na反应生成
所以一个C2H10O分子中只有一个H原子可以被钠置换(1分)
说明C6H6O分子里的6个氢原子中有一个与其他5个不同。(1分)
(4)植物油(1分)
植物油和氢氧化钠溶液都能溶于乙醇(2分)
29.(17分)
(1)光照,取代反应,氧化,消去(4×1分)
(2)C6H12, (CH3)2CCH2CH2OH (2×2分)
(3)(CH3)2CCHC1CH3+NaOH (CH3)3CCH=CH2+NaC1+H2O(2分)
(CH3)3CCH=CH2+NaC1+H2O(2分)
或(CH3)CCHC1CH3 (CH3)3CCH=CH2+HC1
(CH3)3CCH=CH2+HC1
2(CH3)3CCH2CH2OH+O2 2(CH3)3CCH2CHO+2H2O (2分)
2(CH3)3CCH2CHO+2H2O (2分)
 (CH3)3CCH2COOH+CH3CH2(CH3)2CH2OH
(CH3)3CCH2COOH+CH3CH2(CH3)2CH2OH H2O+(CH3)CCH2COOCH2(CH3)2CH2CH3(2分)
H2O+(CH3)CCH2COOCH2(CH3)2CH2CH3(2分)
(4)(CH3)
30(22分)
I.(12分)
(1)成熟区(根毛区)(l分) 分生区(1分)
(2)主动运输(1分) 减少(1分)
主动运输需要能量,缺氧时根细胞呼吸作用降低,产生能量减少(2分)
(3)幼叶(2分) 两个相对独立(2分)
(4)在施肥后一段时间内,由于土壤溶液浓度升高,根细胞渗透作用减弱,吸水速率减慢;(1分)一段时间后由于矿质元素被吸收,根细胞液浓度升高土壤溶液浓度降低,根细胞渗透作用增强,吸水速率加快(1分)
Ⅱ.(10分)
(2)实验过程:①膜(2分)
②已标记的核(2分)
③检查新形成的核膜是否具有放射性(2分)
(3)预测结果:
①若新形成核膜具有放射性,则由旧核膜的碎片连接而成(2分)
②若新形成核膜无放射性,则由内质网膜形成(2分)
31.(20分)
(1)酵母菌在无氧条件下进行酒精发酵(酵母菌无氧呼吸产生酒精)(2分)
C6H12O6
(2)最适宜生长的温度为30~35℃,且为好氧型细菌(2分)
(3)②(2分)
(4)编码区是间隔的、,不连续的(2分)出芽生殖(2分)
基因突变、染色体变异(2分)
(5)①(人工)诱变育种(1分) 鉴别(1分)
②对数(1分) 代谢旺盛,个体的形态和生理特性比较稳定(1分)
③有氧呼吸的第二、三阶段(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com