
题目列表(包括答案和解析)
(1)CH3+.CH3-.CH3-都是重要的有机反应中间体,有关它们的说法正确的是________.
A.它们均由甲烷去掉一个氢原子所得
B.它们
互为等电子体,碳原子均采取sp2杂化C.CH3-
与NH3、H3O+互为等电子体,几何构型均为三角锥形D.CH3+
中的碳原子采取sp2杂化,所有原子均共面E.
两个CH3-或一个CH3+和一个CH3-结合均可得到CH3CH3(2)
锌是一种重要的金属,锌及其化合物有着广泛的应用.①指出锌在周期表中的位置:第________周期,第________族,属于________区.
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式________;葡萄糖分子中碳原子杂化方式有________.
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子属于________(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在下图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键.
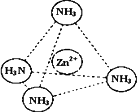
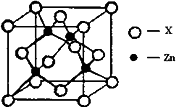
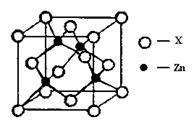
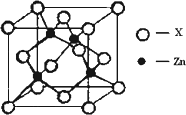
④下图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为________;该化合物晶体的熔点比干冰________(填写“高”或“低”),原因是________.
⑴CH3+.CH3-.CH3-都是重要的有机反应中间体,有关它们的说法正确的是 。
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3.H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个CH3-或一个CH3+和CH3-结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①指出锌在周期表中的位置: 周期, 族, 区。
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式 ;葡萄糖分子中碳原子杂化方式有 。
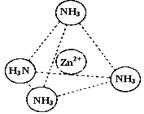
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于 (填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键。
 | |||
 | |||
④右上图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ;该化合物的晶体熔点比干冰高得多,原因是 。
Ⅰ.CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O 2CuCl↓+4H++SO42-
2CuCl↓+4H++SO42-
2CuCl2+SnCl2=2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:
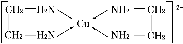
请回答下列问题:
(1)基态Cu原子的核外电子排布式为____________;H、N、O三种元素的电负性由大到小的顺序是_________________________________________________________。
(2)SO2分子的空间构型为________;与SnCl4互为等电子体的一种离子的化学式为________________________________________________________________________。
(3)乙二胺分子中氮原子轨道的杂化类型为________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是_________________________________。
(4)②中所形成的配离子中含有的化学键类型有________(填字母)。
a.配位键 b.极性键 c.离子键 d.非极性键
Ⅱ.固体二氧化碳外形似冰,受热汽化无液体产生,俗称“干冰”,根据干冰晶胞结构回答:
(5)干冰中一个分子周围有________个紧邻分子。
(6)堆积方式与干冰晶胞类型相同的金属有________(从“Cu、Mg、K、Po”中选出正确的),其空间利用率为________。
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO
2CuCl↓+4H++SO![]()
2CuCl2+SnCl2=2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
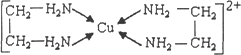
请回答下列问题:
(1)基态Cu原子的核外电子排布式为________.H、N、O三种元素的电负性由大到小的顺序是________.
(2)SO2分子的空间构型为________.与SnCl4互为等电子体的一种离子的化学式为________.
(3)乙二胺分子中氮原子轨道的杂化类型为________.乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是________.
(4)②中所形成的配离子中含有的化学键类型有________.(填字母)
a.配位键
b.极性键
c.离子键
d.非极性键
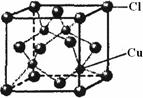
(5)CuCl的晶胞结构如图所示,其中Cl原子的配位数为________.
A.(1)CH3+.CH3-.CH3-都是重要的有机反应中间体,有关它们的说法正确的是________.
A.它们均由甲烷去掉一个氢原子所得
B.它们
互为等电子体,碳原子均采取sp2杂化C.CH3-
与NH3.H3O+互为等电子体,几何构型均为三角锥形D.CH3+
中的碳原子采取sp2杂化,所有原子均共面E.
两个CH3-或一个CH3+和CH3-结合均可得到CH3CH3(2)
锌是一种重要的金属,锌及其化合物有着广泛的应用.①指出锌在周期表中的位置:________周期,________族,________区.
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式________;葡萄糖分子中碳原子杂化方式有________.
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子属于________(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在下图中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键.
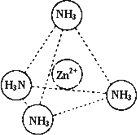
④下图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为________;该化合物的晶体熔点比干冰高得多,原因是________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com