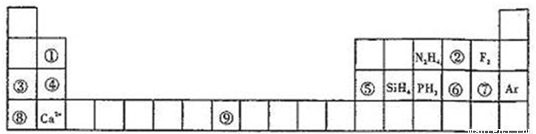
元素周期表揭示了许多元素的相似性和递变规律,同一周期元素构成的某些微粒往往具有相同的电子数,周期表中主族元素可以构成许多电子数为10或18的微粒.如下列周期表中所示的一些分子或离子.
(1)写出⑨元素的原子核外电子排布式______.
(2)比较③、⑤分别与⑦形成的化合物水溶液的pH大小______>______(写化学式).
(3)①元素与⑤元素的氢氧化物有相似的性质,写出①元素的氢氧化物与足量的NaOH溶液反应的化学方程式______.
(4)含有⑥元素的某种18电子的离子和H
+及OH
-均可发生反应,分别写出反应的离子方程式:
______,______.