
题目列表(包括答案和解析)
| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2(mol) | O2(mol) | SO3(mol) | N2 | |||
| 甲 | 2 | 1 | 0 | 0 | Q1 | X1 |
| 乙 | 1 | 0.5 | 0 | 0 | Q2=39.4 | X2 |
| 丙 | 1 | 0.5 | 0 | 1 | Q3 | X3 |
| 丁 | 1.8 | 0.9 | 0.2 | 0 | Q4 | X4 |

| t1-t2 | t3-t4 | t4-t5 | t6-t7 |
| K1 | K2 | K3 | K4 |
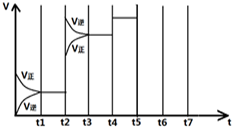 在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙两个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热(Q),及平衡时的转化率(X)如下表所示:
在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙两个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热(Q),及平衡时的转化率(X)如下表所示:| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2 | O2 | SO3 | N2 | |||
| 甲 | 2 | 1 | 0 | 0 | Q1 | X1 |
| 乙 | 1 | 0.5 | 0 | 1 | Q2= 39.4 |
X2 |
| t 1-t 2 | t 3-t 4 | t 4-t 5 | t 6-t 7 |
| K1 | K2 | K3 | K4 |
| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2(mol) | O2(mol) | SO3(mol) | N2 | |||
| 甲 | 2 | 1 | Q1 | X1 | ||
| 乙 | 1 | 0.5 | Q2=39.4 | X2 | ||
| 丙 | 1 | 0.5 | 1 | Q3 | X3 | |
| 丁 | 1.8 | 0.9 | 0.2 | Q4 | X4 | |

| t 1-t 2 | t 3-t 4 | t 4-t 5 | t 6-t 7 |
| K1 | K2 | K3 | K4 |
(13分)
Ⅰ 某温度下,密闭容器中充入1 mol N2和3 mol H2,使之反应合成NH3,平衡后,测得NH3的体积分数为w,如果温度不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为w,N2、H2、NH3的物质的量分别用x、y、z表示.
(1)恒温恒容条件下:若x=0.75 mol, 则y=________, z=________.
(2)恒温恒压条件下,x、y、z(均不小于0)满足的一般条件是_______________________.
Ⅱ 一定条件下,可逆反应X(g)+Y(g) 2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y)=0.1 mol /L ; c (Z)=1.6 mol /L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是________ ____, a的取值范围为_______________
Ⅲ 在10℃和4×105Pa的条件下,当反应aA(g) dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
| 压强(Pa) | 4×105 | 6×105 | 10×105 | 20×105 |
| D的浓度(mol/L) | 0.085 | 0.126 | 0.200 | 0.440 |
(1)压强从4×105Pa增加到6×105Pa时,平衡向 (填“正”或“逆”)方向移动,理由是_________________________________________________________________
(2)压强从10×105Pa增加到20×105Pa时,平衡向_______(填“正”或“逆”)方向移动
(13分)
Ⅰ 某温度下,密闭容器中充入1 mol N2和3 mol H2,使之反应合成NH3,平衡后,测得NH3的体积分数为w,如果温度不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为w,N2、H2、NH3的物质的量分别用x、y、z表示.
(1)恒温恒容条件下:若x=0.75 mol, 则y=________, z=________.
(2)恒温恒压条件下,x、y、z(均不小于0)满足的一般条件是_______________________.
Ⅱ 一定条件下,可逆反应X(g)+Y(g)  2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y)
=0.1 mol /L ; c (Z)=1.6 mol /L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是________ ____, a的取值范围为_______________
2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y)
=0.1 mol /L ; c (Z)=1.6 mol /L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是________ ____, a的取值范围为_______________
Ⅲ 在10℃和4×105Pa的条件下,当反应aA(g)  dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
|
压强(Pa) |
4×105 |
6×105 |
10×105 |
20×105 |
|
D的浓度(mol/L) |
0.085 |
0.126 |
0.200 |
0.440 |
(1)压强从4×105Pa增加到6×105Pa时,平衡向 (填“正”或“逆”)方向移动,理由是_________________________________________________________________
(2)压强从10×105Pa增加到20×105Pa时,平衡向_______(填“正”或“逆”)方向移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com