
题目列表(包括答案和解析)
(16分)环境中常见的重金属污染有:汞、铅、锰、铬、镉。处理工业废水中常含有的Cr2O2-7和CrO2-4离子,常用的方法有两种。
方法1:还原沉淀法
该法的工艺流程为:

其中第①步存在平衡:

(1)写出第①步反应的平衡常数表达式 。
(2)关于第①步反应,下列说法正确的是 。
A.通过测定溶液的pH值可以判断反应是否已达平衡状态[来源:Zxxk.Com]
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 molCr2O2-7离子,需要 mol的FeSO4·7H2O。
(4)第③步除生成的Cr(OH)3,还可能生成的沉淀为
。在溶液中存在以下沉淀溶解平衡: 常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
方法2:电解法
(5)实验室利用如图装置模拟电解法处理含Cr2O2-7的废水,电解时阳极反应式为 ,阴极区反应式为 ,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是 。

工业和交通运输业的迅速发展,机动车数量的日益增多,人类向大气中大量排放烟尘和S02等有害气体等,对大气造成了严重的污染。一研究性学习小组对某市的空气污染情况和SO2参与的反应进行了研究。
(1)空气污染易形成酸雨。从环境保护的角度认为:雨水的pH<5.6时,就判断为酸m。,
该小组同学测定某次雨水中只含硫酸,且浓度为5×10-5mol.L,这次降雨 (填是或不是)酸雨。
(2)该小组同学欲测定空气(含氮气、氧气、 二氧化碳、 二氧化硫等)中,SO2,的体积百分含量(标况),请利用溴水、BaCl2溶液及必要的实验仪器设计实验方案,写出简要的实骤 。
上述实验过程中发生反应的离子方程式为 ,其中SO2参与的反应中,SO2显 性。
(3)在T℃时,反应![]() ‹0的平衡常数K=6×102,则
‹0的平衡常数K=6×102,则
①温度升高,化学平衡移动后,平衡常数K值 (填“增大”、“减少”或“不变”)。
②在T℃时,某生向容积为2 L的密闭容器中充入0.4 mol SO2、0.18 molO2和 1.2 mol SO3混合气体,此时该反应是否处于化学平衡状态 (填“是”或“否”),化学反应速率v(正)
v(逆)(填“大于”、“等于”或“小于”),你判断的依据是 。
环境中常见的重金属污染物有:汞.铅.锰.铬.镉。处理工业废水中含有的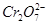 和
和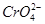 ,常用的方法有两种。
,常用的方法有两种。
方法1 还原沉淀法该法的工艺流程为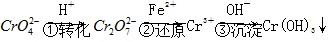 。
。
其中第①步存在平衡2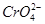 (黄色)+2H+
(黄色)+2H+
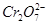 (橙色)+H2O。
(橙色)+H2O。
(1)写出第①步反应的平衡常数表达式_________________________________。
(2)关于第①步反应,下列说法正确的是________。
A.通过测定溶液的pH可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 mol 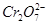 ,需要________mol的FeSO4·7H2O。
,需要________mol的FeSO4·7H2O。
(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为________。在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):______________________________________________。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):______________________________________________。
方法2 电解法
(5)实验室利用如图装置模拟电解法处理含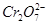 的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________________________。
的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________________________。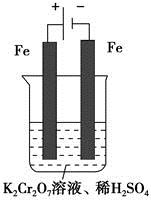
某校化学小组同学设计以下装置,进行不同的实验。其中a为用于鼓入空气的气囊,b为铜丝螺旋,c为喷有少量碱液的棉花,d中盛有冰水。

(1)若用A装置做乙醇与乙酸酯化反应的实验,则还需连接的仪器是(填装置编号) ,该仪器中应加入的试剂是 。要加快酯化反应的速率,通常采用的措施是 。写出含18O的乙醇与乙酸反应的化学方程式
。
(2)该小组同学欲做浓硫酸与铜反应的实验,并检验产生的二氧化硫气体,他们应选用的装置是 ,用于检验产物二氧化硫可选用的试剂是 。在所选装置中 (填有关字母)部分是为了减少二氧化硫对空气的污染,相应的离子方程式为 。
(3)该小组同学欲做乙醇氧化成乙醛的实验,他们可选用的装置是 (填装置编号)。
(4)该小组同学欲用A装置做铜与浓硝酸反应的实验,请你判断该实验是否可行 (填“是”或“否”),若不可行,对装置的改进措施是 (若认为可行,此问可不答)。
(8分)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]·3H2O。42.2 g K4[Fe(CN)6]·3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。
试回答下列问题:
(1)试确定150 ℃时固体物质的化学式_____________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为_____________________________________________________。
(3)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为__________________________。
(4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全_____________。(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com