
题目列表(包括答案和解析)
利用氢气还原氧化铜的实验测定水的组成.装置如图所示:
已知氧化铜和玻璃管在通入氢气前的总质量是56 g,在通入氢气完全反应后的总质量为51.2 g,氯化钙和U形管在实验前的总质量是104.6 g,在实验后的总质量是110 g求:

(1)完全反应后生成水的质量;
(2)生成的水中氧元素的质量;
(3)生成的水中氢元素的质量;
(4)水中氢、氧元素的质量比;
(5)若已知氢的相对原子质量为1,氧的相对原子质量为16,求水的化学式.
利用氢气还原氧化铜的实验,测定水的组成,装置如图所示:
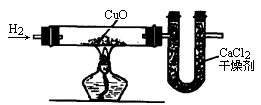
已知氧化铜和玻璃管在通入氢气前的总质量是
56g,在通入氢气完全反应后的总质量为51.2g,氯化钙和U形管在实验前的总质量是104.6g,在实验后的总质量是110g,求:
(1)完全反应后生成水的质量;
(2)生成的水中氧元素的质量;
(3)生成的水中氢元素的质量;
(4)水中氢和氧元素的质量比.
 利用氢气还原氧化铜实验测定水的组成如图1,请回答下列问题:
利用氢气还原氧化铜实验测定水的组成如图1,请回答下列问题:| 实验前 | 实验后 | |
| 氧化铜和玻璃管的总质量 | 65.6g | 59.2g |
| 氧化钙与U型管的总质量 | 100.8g | 108.0g |
| 65.6g-59.2g |
| (108.0-100.8)-(65.6g-59.2g) |
| 6.4g |
| 0.8g |
| 8 |
| 1 |
| 65.6g-59.2g |
| (108.0-100.8)-(65.6g-59.2g) |
| 6.4g |
| 0.8g |
| 8 |
| 1 |
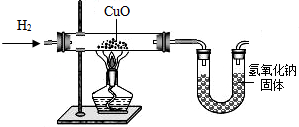
利用氢气还原氧化铜实验测定水的组成(如图所示).请回答下列问题:

(1)实验中,用锌粒和稀硫酸反应制取氢气.实验开始前需要先检验______,然后应先通一段时间氢气,再加热氧化铜进行反应,其主要目的是______,写出该反应的化学方程式______.
(2)用现有的装置测得,水中氢、氧元素的质量比大于1:8,出现该结果的可能的原因有哪些?______.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com