
题目列表(包括答案和解析)
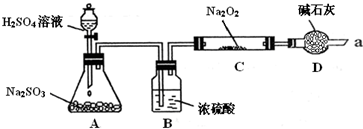
| 实验操作 | 预期现象 | 结 论 |
| 步骤一:取少量C中固体产物于试管中,加入适量的蒸馏水溶解,分别取少量于A、B试管中 | 固体完全溶解,得到无色透明溶液 | / |
| 步骤二:取试管A,向溶液中加入 |
假设1 或假设3成立;若没有该现象则假设2成立. | |
| 步骤三:取试管B,向其中先加入 再加入 |
产生 再加入试剂看到产生白色沉淀. |
假设3成立.若无白色沉淀产生则假设1成立. |
| 11.82g |
| 197g/mol |
| 11.82g |
| 197g/mol |
| 实验步骤 | 现象 | 结论 |
| 取少量NaOH溶液样品于试管中,先滴加足量的CaCl2溶液,然后再滴加酚酞试液. | NaOH溶液部分变质 |
请认真运算,并将正确答案填写在空白处。(不得使用计算器)
(1)恒温下,向pH = 6的蒸馏水中加入2.3 g金属钠充分反应后,再加蒸馏水稀释至1L,所得溶液的pH =
(2)常温下,pH = 5的稀H2SO4溶液稀释1000倍,则稀释后溶液中 的比值为
的比值为
(3)25℃,在等体积的①pH=0的H2SO4溶液②0.05 mol/L的Ba(OH)2溶液③pH=10的K2S溶液④pH=5的NH4NO3溶液中发生电离的水的物质的量之比为
(4)当NH3·H2O和盐酸混合恰好中和成c mol/L的NH4Cl稀溶液,试用c、c(H+)及氨水的Kb值、水的Kw值表示该溶液中 的平衡浓度,c(
的平衡浓度,c( )平=
)平=
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com