(本题16分)
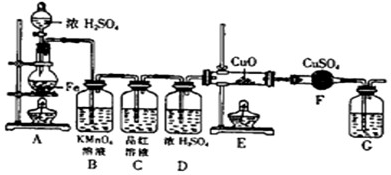
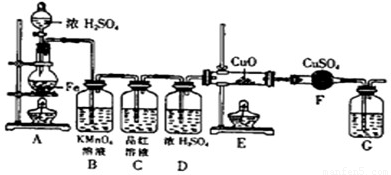
(1)为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
 物质 物质
T/℃ n/mol
| NO
| CO
| E
| F
|
初始
| 0.100
| 0.100
| 0
| 0
|
T1
| 0.020
| 0.020
| 0.080
| 0.040
|
T2
| 0.010
| 0.010
| 0.090
| 0.045
|
①请结合上表数据,写出NO与CO反应的化学方程式
.
②根据表中数据判断,温度T
1和T
2的关系是(填序号)__________。
A.T
1>T
2 B.T
1<T
2 C.T
1=T
2 D.无法比较
(2)已知:4NH
3(g) + 3O
2(g) = 2N
2(g) + 6H
2O(g); ΔH= - 1266.8 kJ/mol
N
2(g) + O
2(g) =" 2NO(g)" ; ΔH =" +" 180.5kJ/mol,
则氨催化氧化的热化学方程式为________________________________________。
(3)500℃下,在A、B两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。

当合成氨在容器B中达平衡时,测得其中含有1.0molN
2,0.4molH
2,0.4molNH
3,此时容积为2.0L。则此条件下的平衡常数为___________;保持温度和压强不变,向此容器中通入0.36molN
2,平衡将___________(填“正向”、“逆向”或“不”)移动。
(4)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的两种Cu
2O分别进行催化分解水的实验:

ΔH >0
水蒸气的浓度(mol·L
-1)随时间t (min)变化如下表:
序号
| 温度
| 0
| 10
| 20
| 30
| 40
| 50
|
①
| T1
| 0.050
| 0.0492
| 0.0486
| 0.0482
| 0.0480
| 0.0480
|
②
| T1
| 0.050
| 0.0488
| 0.0484
| 0.0480
| 0.0480
| 0.0480
|
③
| T2
| 0.10
| 0.094
| 0.090
| 0.090
| 0.090
| 0.090
|
可以判断:实验①的前20 min的平均反应速率 ν(O
2)=
;催化剂的催化效率:实验①
实验②(填“>”、“<”)。
(5)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。原理:使用惰性电极和乙醛-Na
2SO
4溶液为电解质溶液,乙醛分别在阴、阳极转化为乙醇和乙酸。
总反应为:2CH
3CHO+H
2O
CH
3CH
2OH+CH
3COOH。
过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别为:
4OH
--4e
-═O
2↑+2H
2O;
。

 物质
物质
 ΔH >0
ΔH >0 CH3CH2OH+CH3COOH。
CH3CH2OH+CH3COOH。