
题目列表(包括答案和解析)
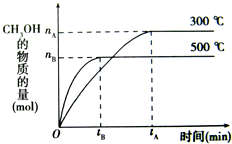 一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)?CH3OH(g)达到平衡状态.
一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)?CH3OH(g)达到平衡状态.| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
| ||
| tB |
| ||
| tB |
| 1 |
| 2 |

| [NH3]2 |
| [N2][H2]3 |
| [NH3]2 |
| [N2][H2]3 |
 2NH3(g)+Q(Q>0),反应中NH3的物质的量浓度的变化情况如图:
2NH3(g)+Q(Q>0),反应中NH3的物质的量浓度的变化情况如图:
| [NH3]2 |
| [N2]?[H2]3 |
| [NH3]2 |
| [N2]?[H2]3 |


| A、金属被利用的早晚取决于其在地壳中的含量,在地壳中含量越高,被利用的越早 | B、金属冶炼的实质是金属阳离子借助于还原反应转化为金属单质的过程 | C、工业上冶炼铝是利用C或者CO还原Al2O3得到单质铝 | D、工业上冶炼铁利用还原剂CO通过置换反应得到单质铁 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com