我区某中学化学研究性学习小组为了探究水垢的成因和主要成分,从教材和互联网上查得如下资料:
Ⅰ.锅炉用水硬度高了十分危险,因为锅炉内结垢后不仅浪费燃料,而且会使锅炉内管道局部过热,易引起管道变形或损坏,严重时还可能引起爆炸.
Ⅱ.用适量的盐酸可以将热水瓶胆壁上的水垢[主要成分是Mg(OH)
2和CaCO
3]除去.
Ⅲ.天然水中一般都含有Ca
2+、Mg
2+、HCO
3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质--水垢.
(1)小李同学对该井水进行如下探究,其做法及结论合理的是
.(填序号)
A、用烧杯取少量该井水,加入适量肥皂水,搅拌,发现有较多浮渣产生,说明该井水为硬水.
B、用烧杯取少量井水,加入一定量活性炭,搅拌、过滤,可吸附井水中的钙、镁离子,并使井水软化.
C、取较多井水,加热煮沸,煮沸后的井水硬度降低.
(2)某同学为了粗略测定某锅炉水垢中CaCO
3的质量分数,取6.0g 样品,逐滴加入稀盐酸至不再产生气泡为止,共生成2.2g CO
2气体.试计算样品中CaCO
3的质量分数.
(3)若要计算上述反应所消耗的盐酸溶液的质量分数,题中还缺少的一个数据是
.
(4)乙同学设计了下列实验装置进一步探究水垢的成分.其主要操作步骤如下:
①按图组装仪器,将50g水垢试样放入锥形瓶中,加入足量某酸溶液;
②测量一定时间内干燥管内物质增加的质量(见下列曲线);
③待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
④再次称量干燥管内物质增加的质量;
⑤重复③和④的操作,直至干燥管内物质质量不变.
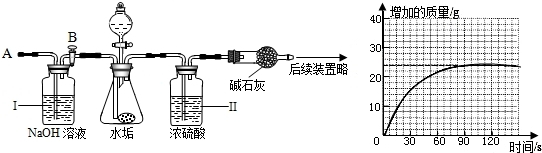
研究性小组的同学通过简单计算,认为水垢中一定含有少量MgCO
3,理由是
.

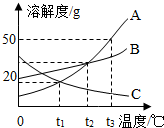 (2013?顺德区质检)根据图A、B、C三种固体的溶解度曲线回答:
(2013?顺德区质检)根据图A、B、C三种固体的溶解度曲线回答: