
题目列表(包括答案和解析)
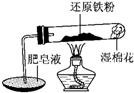 已知在温度低于570℃时,还原铁粉与水蒸气反应的产物是FeO,高于570℃时,生成Fe3O4.老师用图示实验装置,完成了还原铁粉与水蒸气反应的演示实验.
已知在温度低于570℃时,还原铁粉与水蒸气反应的产物是FeO,高于570℃时,生成Fe3O4.老师用图示实验装置,完成了还原铁粉与水蒸气反应的演示实验.| 实验 编号 |
实验操作 | 实验现象 |
| ① | 取少量黑色粉末放入试管中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| ② | 向试管中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
| A、试管内的固体一定含有铁粉 |
| B、试管内的固体一定不含有Fe3O4 |
| C、不能确定试管内的固体一定含有FeO |
| D、可通过将试管内固体彻底还原,分析其质量减小的方法来确定是否含有Fe3O4 |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
(6分)设计出燃料电池使汽油氧化直接产生电流是对21世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。回答如下问题:
(1)以壬烷(C9H20)代表汽油,这个电池放电时发生的化学反应的化学方程式是:
(2)这个电池的正极发生的反应是:
负极发生的反应是:
固体电解质里的O2-的移动方向是:
向外电路释放电子的电极是:
碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
步骤一:废铜屑制硝酸铜
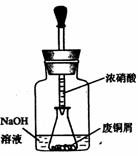
如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
 完成下列填空:
完成下列填空:
35.写出浓硝酸与铜反应的离子方程式。
36.上图装置中NaOH溶液的作用是__。反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有____(填写化学式)。
37.步骤二中,水浴加热所需仪器有____、__(加热、夹持仪器、石棉网除外);洗涤的目的是____。
38.步骤二的滤液中可能含有CO32-,写出检验CO32-的方法。
39.影响产品产量的主要因素有____。
40.若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是____。
用18.4mol·L-1的浓H2SO4配制100mL浓度为1mol·L-1的H2SO4溶液,其操作可分为以下各步:
(A)用量筒取 mL浓H2SO4缓缓注入装有约50mL蒸馏水的烧杯中,并用玻璃棒不断搅拌
(B)用约30mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗液都倒入100mL容量瓶里
(C)将稀释后H2SO4溶液小心倒入100mL容量瓶里
(D)检查100mL容量瓶口部是否会发生滴漏
(E)将蒸馏水直接加入容量瓶,至液面接近环形刻度线 处
(F)盖紧瓶塞,反复颠倒振荡,摇匀溶液
(G)用 向容量瓶里逐滴滴入蒸馏水,至液面最低点恰好和环形刻度线相切
据此填写:(1)上述各步的空白处。
(2)正确的操作顺序是(字母填写) 。
(3)进行A步操作应选择下列量器:①10mL量筒;②50mL量筒;500mL量筒;④1000mL量筒中的(填序号) 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com