
题目列表(包括答案和解析)
题目:化学电池在通讯、交通及日常生活中有着广泛的应用。
前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O ![]() 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
(1)已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,放电就是使用电池的过程,充电是给电池补充电量的过程。以下说法中正确的是
① 以上反应不属于置换反应 ② 以上反应是复分解反应
③ 充电时化学能转变为电能 ④ 放电时化学能转变为电能
A.①③ B.②④ C.①④ D.②③
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍锡电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为
(3)另一种常用的电池是锂电池(它是一种碱金属元素,其相对原子质量为7,由于它的比容量(单位质量电板材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用的时间可长达十年。它的负极用金属锂制成;电池总反应可表示为:Li+MnO2→LiMnO2试回答:锂电池比容量特别大的原因是
锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因
(4)下图是废弃镍钢电池中的重金属渗入水体后,进入人体的一条途径:
生物体D中重金属浓度 (大于、等于、小于)生物体A中重金属浓度,这是通过食物链 作用所引起的。除上述途径外,被污染水体中的重金属还可以直接通过 (途径)_________进入人体。
(5)下图是两个电池外壳上的说明文字某型号进口电池
某型号进口电池 | 某型号国产电池 |
| GNY 0.6(KR-AA) |
上述进口电池的电动势是 伏。上述国产电池最多可放出 毫安时的电量;若该电池平均工作电流为0.03安,则最多可使用 小时。
已知:在室温时H2O H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH  H++
CH3COO- Ka=1.8×10-5
H++
CH3COO- Ka=1.8×10-5
(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)的比值 (填“增大”或“减小”或“不变”)
(2)醋酸钠水解的离子方程式为 。当升高温度时,C(OH—)将 (填“增大”“减小”“不变”);
(3)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是 。
(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)_______________ c(CH3COO-)(填“大于”、“小于”或“等于”),
(6)室温时,若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2 mL混合,则下列说法不正确的是____________。
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(7)在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol·L-1。向其中加入固
体醋酸钠后测得溶液的C(OH-)为2.2×10-5mol·L-1,以上三种金属离子中 能生成沉淀,原因是 。
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、
KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL0.5mol·L-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H+)
= mol/L。
35.目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是( )
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
A.①③ B.②④ C.①④ D.②③
36.废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为 。
37.下图是废弃镍镉电池中的重金属渗入水体后,进入人体的一条途径:
![]()
生物体D中重金属浓度 (大于、等于、小于)生物体A中重金属浓度,这是通过食物链 作用所引起的。除上述途径外,被污染水体中的重金属还可以直接通过 (途径)进入人体。
38.另一种常用的电池是锂电池(锂是一种碱金属元素,其相对原子质量为7),由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年。它的负极用金属锂制成,电池总反应可表示为:Li+MnO2![]() LiMnO2
LiMnO2
试回答:锂电池比容量特别大的原因是 。锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因 。
39.下图是两个电池外壳上的说明文字
某型号进口电池 | 某型号国产电池 |
RECHARGEABLE 1.2V 500mAh STANDARD CHARGE 15h at 50mA | GNY 0.6(KR-AA) 1.2V 600mAh RECHARGEABLE STANDARDCHARGE 15h at 60mA |
上述进口电池的电动势是 伏。上述国产电池最多可放出 毫安时的电量:若该电池平均工作电流为0.03安,则最多可使用 小时。
化学电池在通讯、交通及日常生活中有着广泛的应用。
⑴下列相关说法正确的是
A.通过某种电池单位质量或单位体积所能输出能量的多少,可以判断该电池的优劣
B.二次电池又称充电电池或蓄电池,这类电池可无限次重复使用
C.除氢气外,甲醇、汽油、甲烷、乙烷、氧气等都可用作燃料电池的燃料
D.近年来,废电池必须进行集中处理的问题被提到议事日程,其首要原因是电池外壳的金属材料需要回收
⑵目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:
2Ni(OH)2+Cd(OH)2 Cd+2NiO(OH)+2H2O
已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,下列说法正确的是:
A.以上反应是可逆反应 B.反应环境为碱性
C.电池放电时Cd作负极 D.该电池是一种二次电池
⑶在宇宙飞船和其它航天器上经常使用的氢氧燃料电池是一种新型电池,其结构如图所示:a、b两个电极均由多孔的炭块组成,通入的氢气和氧气由孔隙中逸入,并在电极表面发生反应而放电。
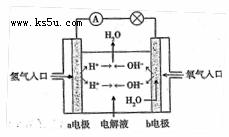
①a电极是电源的 极
②若该电池为飞行员提供了36Kg的水,则电路中通过了 mol电子。
(16分)运用相关原理,回答下列各小 题:
题:
Ⅰ.已知NaHSO4在水中的电离方程式为NaHSO4=Na++ H++ SO4 2-。
2-。
(1)在NaHSO4溶液中c(H+) c(OH-)+ c(SO42-)(填“>”、“=”或“< ”
” 下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。
下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。
(2)将 20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为: ;向此反应后的溶液中滴加
20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为: ;向此反应后的溶液中滴加
0.001 mol·L-1BaCl2溶液,首先析出的沉淀是 。[KSP(BaSO4)=1.1×10-10mol2·L-2;KSP(BaCO3)=5.1×10-9mol2·L-2]
Ⅱ.已知:在25时 H2O H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH
 H++CH3COO--> Ka=1.8×10-5
H++CH3COO--> Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh的表达式为 。当升高温度时,Kh将 (填“增大”“减小”“不变”);
(4)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)
 为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
(5)0.9mol·L-1醋酸钠溶液中[OH-]= mol·L-1
在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol·L-1。向其中加入固体醋酸钠,使其浓度为0.9mol·L-1,以上三种金属离子中 能生成沉淀,原因是 。
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、
KSP[Cd(OH)2]=2.5×10-14、 =2.2)
=2.2)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com