
题目列表(包括答案和解析)
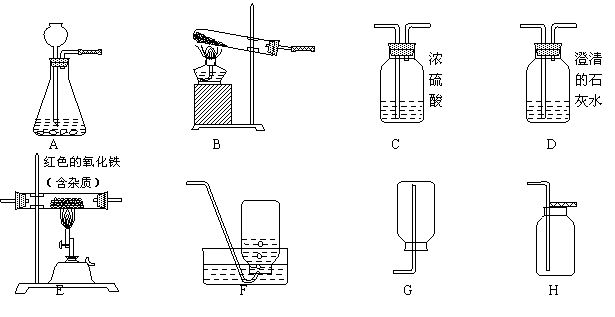 如下图所示为实验室中常见的气体制备、净化、收集和性质实验的部分仪器。试根据题目要求,回答下列问题:
如下图所示为实验室中常见的气体制备、净化、收集和性质实验的部分仪器。试根据题目要求,回答下列问题:
(1)若用过氧化氢溶液和二氧化锰制取并收集干燥的氧气,并进行氧气的验证性实验。
制取并收集干燥的氧气所选仪器的连接顺序为 (填写仪器序号字母),证明集气瓶中收集到的气体为氧气的方法是_____________________________________________。
(2)小强同学欲用一氧化碳气体(含少量二氧化碳气体)测定某不纯氧化铁样品的纯度(杂质不参与任何反应),并验证反应中气体生成物的性质,小强同学取2g氧化铁样品设计了实验方案:气体流向是从左向右,选择的仪器按D1→C→E→D2顺序连接,然后进行实验(D1 、D2为两个盛有石灰水的洗气瓶,假设有关反应均反应完全)。
①仪器D1处发生反应的化学方程式是 。
②通过测量反应前后D2处装置的质量变化,来计算氧化铁的纯度。若其他操作正确,反应结束后测得D2装置增重了1.32g(不考虑空气中成分对D2装置质量的影响),则此氧化铁样品中氧化铁的质量分数为________。若上述连接仪器没有使用D1装置,计算出的氧化铁样品纯度与实际值比较将___________(填“一定偏大”、“一定偏小”、“基本一致”之一)。
③对于小强同学设计的这个实验装置,你认为存在的不足是
你的具体改进建议是 。
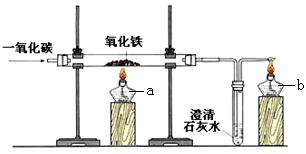
铁矿石冶炼成铁是一个复杂的过程。炼铁的原理是利用一氧化碳与氧化铁的反应,该化学方程式为 ▲ 。
(1)某钢铁厂每天需消耗5000t含氧化铁76%的赤铁矿石,该厂理论上可以日产含铁98%的生铁的质量是多少?
(请写出计算过程,结果精确到0.1t)▲
(2)某化学兴趣小组在实验室中模拟炼铁原理的实验,并对固体产物的成分进行探究。
 【设计实验】 用一氧化碳还原纯净的氧化铁粉末,实验装置如右图,酒精灯b的作用是 ▲ 。
【设计实验】 用一氧化碳还原纯净的氧化铁粉末,实验装置如右图,酒精灯b的作用是 ▲ 。
【进行实验】该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)。
②反应后玻璃管和内盛黑色固体的总质量m(冷却到室温称量)。
【分析与讨论】本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
【查阅资料】
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关。
②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁。
③
| 物质 性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
【进一步实验和得出结论】
①该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和 ▲ 。
②该小组同学将黑色固体粉末投入硫酸铜溶液中,一段时间后无紫红色固体析出,则该黑色固体粉末为 ▲ 。其实,进行如上图所示实验后,若测得反应后玻璃管和内盛黑色固体的总质量m为 ▲ g,也能得出这个结论。
【反思与评价】一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度和延长反应时间。上图所示实验装置中,应作的一处修改是 ▲ 。
| 物质 性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
 18、某化学兴趣小组对“NaOH溶液与稀盐酸是否恰好完全反应”进行探究.请你参与他们的探究活动,并回答有关问题.
18、某化学兴趣小组对“NaOH溶液与稀盐酸是否恰好完全反应”进行探究.请你参与他们的探究活动,并回答有关问题.| 实验步骤 | 实验现象 | 结论 |
| 取 取2mL NaOH溶液于试管中中,滴入一定量的稀盐酸,振振荡后加入镁条 | 若 有气泡冒出 |
稀盐酸过量 |
| 若没有明显现象 | NaOH溶液与稀盐酸恰好完全反应 |
 (1)根据图1实验示意图回答问题:
(1)根据图1实验示意图回答问题:
| ||
| ||
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com