(2012?大兴区一模)亚铁盐在空气中易被氧化,但是形成复盐可稳定存在.硫酸亚铁铵[(NH
4)
2SO
4?FeSO
4?6H
2O 商品名莫尔盐]是一种重要的化学试剂,实验室用废铁片制取硫酸亚铁铵的流程如下方案一所示:
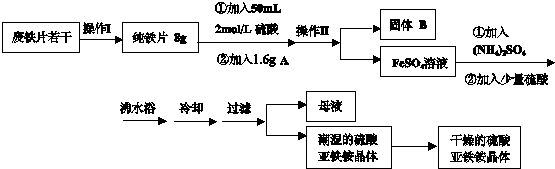
请回答下列问题:
(1)操作Ⅰ主要包括除油、除杂、过滤、烘干、称量等过程,其中除油污需要的最佳试剂
c
c
(填序号)
a.H
2O b.3mol?L
-1 H
2SO
4 c.热的10%的Na
2CO
3溶液
(2)若A物质为CuSO
4,其加入的目的是
形成微小原电池,加快铁与硫酸反应速率
形成微小原电池,加快铁与硫酸反应速率
,则固体B的成分为
铁和铜
铁和铜
.
(3)操作Ⅱ的名称是
过滤
过滤
,所用主要玻璃仪器有:烧杯、
玻璃棒、漏斗
玻璃棒、漏斗
.
(4)加入少量硫酸可以调节pH为1~2,其作用是
Fe2++2H2O?Fe (OH)2+2H+ NH4++H2O?NH3?H2O+H+加入硫酸保持酸性,抑制Fe2+、NH4+离子的水解,得到更多的产品
Fe2++2H2O?Fe (OH)2+2H+ NH4++H2O?NH3?H2O+H+加入硫酸保持酸性,抑制Fe2+、NH4+离子的水解,得到更多的产品
(结合化学用语和简要语言说明).
(5)选用下列提供的试剂,设计实验验证硫酸亚铁铵晶体中含有Fe
2+离子,而不含Fe
3+.
提供的试剂:稀硫酸,KSCN溶液,新配制的氯水,NaOH溶液.
检验方法:
取硫酸亚铁铵晶体少量溶解于试管中形成溶液,加入KSCN溶液无现象,加入新配制的氯水溶液呈血红色证明含有亚铁离子,不含铁离子
取硫酸亚铁铵晶体少量溶解于试管中形成溶液,加入KSCN溶液无现象,加入新配制的氯水溶液呈血红色证明含有亚铁离子,不含铁离子
.
(6)在此流程中,理论上得到硫酸亚铁铵晶体
39.2
39.2
g(精确到小数点后两位).
相关物质的摩尔质量如下,单位g/mol,(NH
4)
2SO
4:132; FeSO
4:152; H
2O:18
(7)该流程图中的CuSO
4可以发生多种化学反应,如果在CuSO
4溶液中加入一定量的Na
2SO
3和NaCl溶液,加热,生成CuCl沉淀.则生成CuCl的离子方程式是
2Cu
2++SO
32-+2Cl
-+H
2O
2CuCl↓+SO
42-+2H
+2Cu
2++SO
32-+2Cl
-+H
2O
2CuCl↓+SO
42-+2H
+.