
题目列表(包括答案和解析)
| 浓硫酸(分析纯) 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98% |
| 阳离子\阴离子 | OH- | NO3- | Cl- | SO42- | CO32- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
除去碳酸钠 |
取少量该固体样品溶于水配成溶液,滴加适量的 充分反应后过滤 |
有白色沉淀生成 |
有关反应的化学方程式为 |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | 该样品中含有氢氧化钠 |
| 浓硫酸(分析纯) 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98% |
| 阳离子\阴离子 | OH- | NO3- | Cl- | SO42- | CO32- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的______溶液, 充分反应后过滤 | 有白色沉淀生成 | 有关反应的化学方程式为 ______ |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | ______ | 该样品中含有氢氧化钠 |
酸、碱、盐是有广泛用途的重要化合物。某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动。
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)下图是某试剂瓶标签上的内容。要把30 g这种浓硫酸稀释为40%的硫酸,需要水的质量为 g。
(3)熟石灰是一种重要的碱,在工农业生产和日常生活中都有十分广泛的应用。工业上首先是用大理石(主要成分碳酸钙)高温煅烧来制取生石灰,然后再用生石灰与水反应来制取熟石灰。请你写出有关反应的化学方程式。
(4)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验。
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质。则无色溶液可能是 。
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验。已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰。请根据上表部分物质的溶解性表(20℃)所提供的信息,将下表填写完整。
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
| 除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的氯化钡溶液,充分反应后过滤 | 有白色沉淀生成 | 有关反应的化学方程式为 |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | | 该样品中含有氢氧化钠 |
酸、碱、盐是有广泛用途的重要化合物。某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动。
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)下图是某试剂瓶标签上的内容。要把30 g这种浓硫酸稀释为40%的硫酸,需要水的质量为 g。

(3)熟石灰是一种重要的碱,在工农业生产和日常生活中都有十分广泛的应用。工业上首先是用大理石(主要成分碳酸钙)高温煅烧来制取生石灰,然后再用生石灰与水反应来制取熟石灰。请你写出有关反应的化学方程式。
(4)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验。
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质。则无色溶液可能是 。

②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验。已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰。请根据上表部分物质的溶解性表(20℃)所提供的信息,将下表填写完整。
|
实验目的 |
实验操作 |
现象 |
结论或化学方程式 |
|
除去碳酸钠
|
取少量该固体样品溶于水配成溶液,滴加适量的氯化钡溶液,充分反应后过滤 |
有白色沉淀生成
|
有关反应的化学方程式为
|
|
检验是否含有氢氧化钠 |
在滤液中滴加酚酞溶液 |
|
该样品中含有氢氧化钠 |
(5)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数。
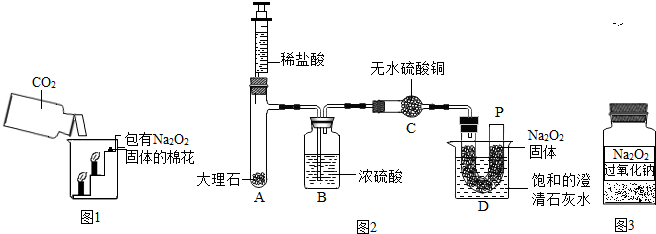
| 实验步骤 | 实验现象 |
| ①取15g变质粉末于一支大试管内,加入适量的水,共收集到1.6g气体,然后用带火星木条检验生成的气体. | 固体完全溶解,有气泡产生,带火星的小木条复燃 |
| ②继续向上述试管中加入足量的石灰水,充分反应. | 有白色沉淀生成 |
| ③将②中物质过滤,得到滤渣,将其洗涤、干燥并称量,得固体5g. |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com