
题目列表(包括答案和解析)
| 指标 | 检测项目及单位 | 限值 |
| 微生物指标 | 总大肠杆菌群(MPN/100ml) | 不得检出 |
| 感官性状指标 | 臭和味 | 无异嗅、无异味 |
| 肉眼可见物 | 无 | |
| 一般化学指标 | pH | 不小于6.5且不大于8.5 |
| 总硬度(以CaCO3计)(mg/l) | 450 | |
| 溶解性总固体( mg/l) | 1000 |

| 指标 | 检测项目及单位 | 限值 |
| 微生物指标 | 总大肠杆菌群(MPN/100ml) | 不得检出 |
| 感官性状指标 | 臭和味 | 无异嗅、无异味 |
| 肉眼可见物 | 无 | |
| 一般化学指标 | pH | 不小于6.5且不大于8.5 |
| 总硬度(以CaCO3计)(mg/l) | 450 | |
| 溶解性总固体( mg/l) | 1000 |
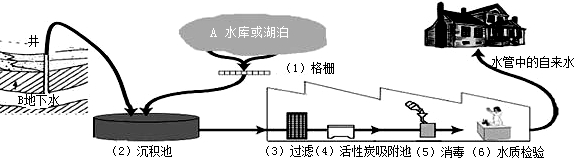
| 指标 | 检测项目及单位 | 限值 |
| 微生物指标 | 总大肠杆菌群(MPN/100ml) | 不得检出 |
| 感官性状指标 | 臭和味 | 无异嗅、无异味 |
| 肉眼可见物 | 无 | |
| 一般化学指标 | pH | 不小于6.5且不大于8.5 |
| 总硬度(以CaCO3计)(mg/l) | 450 | |
| 溶解性总固体( mg/l) | 1000 |

化学小组同学对酸的性质很感兴趣,向老师提出了研究硝酸性质的建议。老师高兴地答应了,并带领同学们进行了硝酸性质的实验探究。
【实验设计】
(1)将石蕊溶液滴入稀硝酸中,预计石蕊溶液由紫色变为________色。
(2)将锌片投入稀硝酸中,预计将产生H2,其名称为________。
【实验验证】
同学们按上述设计做了实验,却发现石蕊变色一会儿后即褪去,锌片投入稀硝酸中后,溶液中冒出气泡,产生无色气体A,在试管口气体A即变成红棕色且有刺激性气味的气体B。
【提出问题】
(1)石蕊溶液变色后为何会褪色?
(2)上述产生的无色气体是什么?硝酸具有哪些特性?
【查阅资料】
看到如此异常的现象,在老师的指导下,同学们上网查到了下列资料:(1)硝酸可与Zn、Cu等多种金属反应,生成相应的硝酸盐,但不生成H2。
(2)含氮元素的某些气态物质的物理性质。
| NH3 | N2 | NO | NO2 | |
| 颜色 | 无色 | 无色 | 无色 | 红棕色 |
| 溶解性 | 极易溶于水 | 不溶于水 | 不溶于水 | 可溶于水 或硝酸 |
【猜想与分析】
(1)小明同学认为石蕊变色后又褪色的原因是由于试管不干净,含有其他杂质造成的,要证明小明的观点,应进行的操作是
________________________________________________________________________。
(2)大家一致认同红棕色气体B是NO2,但对于无色气体A及变化的原因有不同的看法:
①小丽同学认为A是NH3,但遭到大家的一致反对,原因是________________________________________________________________________;
②小强同学认为A是N2,也遭到大家的一致反对,原因是________________________________________________________________________;
③经讨论,最终大家获得了A是NO的共识。NO遇氧气变成NO2的化学方程式为: ________________________________________________________________________。
【实验探究】
小红同学对硝酸能与Cu反应很感兴趣,便取了一小块铜片投入稀硝酸中,发现Cu溶解,也出现上述Zn与稀硝酸反应的类似现象,她便确认生成了NO,并在老师的帮助下,测出恰好反应的Cu和HNO3的质量比为8∶21,由此获得了Cu与稀硝酸的反应方程式为:________________________________________________________________________。
【交流与反思】
根据探究结果,请你解释稀盐酸跟铜不反应而稀硝酸却能跟铜反应的原因:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
| NH3 | N2 | NO | NO2 | |
| 顏色 | 无色 | 无色 | 无色 | 红棕色 |
| 溶解性 | 极易溶于水 | 不溶于水 | 不溶于水 | 可溶于水或硝酸 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com