
题目列表(包括答案和解析)
铁单质及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,3 mol
FeS2参加反应转移________mol
电子。
6SO2+Fe3O4,3 mol
FeS2参加反应转移________mol
电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为
________________________________________________________________________。
从腐蚀废液回收得到金属铜还需要的试剂为
________________________________________________________________________。
(3)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是____________________________________________________ 。
(4)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是________(填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
Ⅰ对;Ⅱ对;有 |
|
B |
常温下铁与稀硫酸反应生成氢气 |
高温下氢气能还原氧化铁生成铁 |
Ⅰ 对;Ⅱ对;无 |
|
C |
铁属于过渡元素 |
铁和铁的某些化合物可以用作催化剂 |
Ⅰ 错;Ⅱ对;无 |
|
D |
铁在空气中表面生成致密氧化膜 |
可用铁罐储存运输浓硫酸、浓硝酸 |
Ⅰ 对;Ⅱ对;有 |
 6SO2+Fe3O4,3 mol FeS2参加反应转移________mol 电子。
6SO2+Fe3O4,3 mol FeS2参加反应转移________mol 电子。 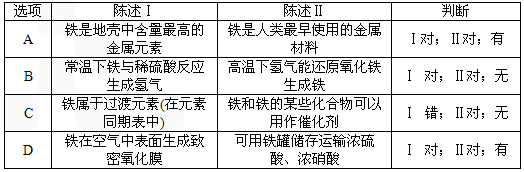
铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为
3FeS2+8O2![]() 6SO2+Fe3O4,有3 molFeS2参加反应,转移________mol电子.
6SO2+Fe3O4,有3 molFeS2参加反应,转移________mol电子.
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为________;从腐蚀废液回收得到金属铜,还需要的试剂是________.
(3)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是________.
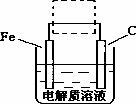
(4)钢铁的电化腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向.
铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为
3FeS2+O2![]() 6SO2+Fe3O4,有3 mol FeS2参加反应,转移________mol电子.
6SO2+Fe3O4,有3 mol FeS2参加反应,转移________mol电子.
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为________;从腐蚀废液回收得到金属铜,还需要的试剂是________.
(3)与明矾相似,硫酸铁也可用作净水剂,其原理是________.
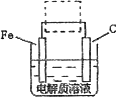
(4)钢铁的电化腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向.

2- 4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com