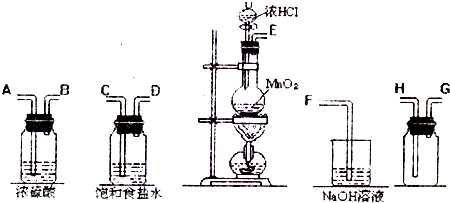
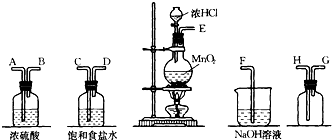
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
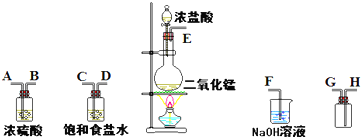
(1)连接上述仪器的正确顺序(填各接口处的字母):
E
E
接
C
C
;
D
D
接
A
A
;
B
B
接
H
H
;
G
G
接
F
F
.
(2)装置中,饱和食盐水的作用是
除去氯气中的HCl杂质
除去氯气中的HCl杂质
;NaOH溶液的作用是
吸收过量的氯气
吸收过量的氯气
.
(3)化学实验中常用湿润的淀粉-KI试纸检验是否有Cl
2产生.如果有Cl
2产生,可观察到
试纸变蓝
试纸变蓝
,反应方程式
2KI+Cl2═2KCl+I2
2KI+Cl2═2KCl+I2
.
(4)写出下列化学反应的方程式:
①气体发生装置中进行的反应:
MnO
2+4HCl(浓)
MnCl
2+Cl
2+2H
2O
MnO
2+4HCl(浓)
MnCl
2+Cl
2+2H
2O
②NaOH溶液中发生的反应:
2NaOH+Cl2═NaCl+NaClO+H2O
2NaOH+Cl2═NaCl+NaClO+H2O
(5)KMnO
4的氧化性比MnO
2强得多,实验室也可以用KMnO
4固体和浓盐酸反应制取氯气,反应方程式如下:
2KMnO
4+16HCl=2KCl+2MnCl
2+5Cl
2↑+8H
2O.
①标出该反应电子转移的方向和数目
②氧化剂和还原剂的物质的量之比为
1:5
1:5
;
③当有0.2mole-转移时被氧化的HCl的质量是
7.3g
7.3g
;该反应中被氧化和未被氧化的盐酸的物质的量之比是
5:3
5:3
,
④如果将20ml 12mol?L
-1的浓盐酸与足量KMnO
4充分反应,实际能收集到的氯气在标准状况下的体积将
D
D
.
A.≥1.68L B.>1.68L C.≤1.68L D.<1.68L.




 MnCl2+Cl2+2H2O
MnCl2+Cl2+2H2O MnCl2+Cl2+2H2O
MnCl2+Cl2+2H2O