
题目列表(包括答案和解析)

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.9 | 11.1 |

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.9 | 11.1 |
二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂.常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水.
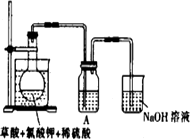
(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为
2KClO3+H2C2O4+2H2SO4![]() 2KHSO4+2ClO2↑+2CO2↑+2H2O
2KHSO4+2ClO2↑+2CO2↑+2H2O
①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60~80℃之间.控制温度的目的是________________,图示装置中缺少的一种必须的玻璃仪器是________________
②装置A用于溶解产生的二氧化氯气体,其中最好盛放________(填字母).
A.20 mL 60℃的温水
B.100 mL冰水
C.100 mL饱和食盐水
D.100 mL沸水
③在烧瓶中加入12.25 g KClO3和9 g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为________
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO![]() ).饮用水中ClO2、ClO
).饮用水中ClO2、ClO![]() 的含量可用连续碘量法进行测定,实验步骤如下:
的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点;
步骤5:再调节溶液的pH≤2.0;
步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点.
①步骤1中若要量取20.00 mL水样,则应选用的仪器是________________
②步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为:
2ClO2+2KI![]() 2KClO2+I2,2Na2S2O3+I2
2KClO2+I2,2Na2S2O3+I2![]() Na2S4O6+2NaI,则步骤4中加入的指示剂为________________,滴定达到终点时溶液的颜色变化为________________
Na2S4O6+2NaI,则步骤4中加入的指示剂为________________,滴定达到终点时溶液的颜色变化为________________
③步骤5的目的是使I-将溶液中的ClO![]() 还原为Cl-以测定其含量,该反应的离子方程式为:________
还原为Cl-以测定其含量,该反应的离子方程式为:________
④若饮用水中ClO![]() 的含量超标,可向其中加入适量的Fe2+将ClO
的含量超标,可向其中加入适量的Fe2+将ClO![]() 还原为Cl-,则该反应的氧化产物为________(填化学式)
还原为Cl-,则该反应的氧化产物为________(填化学式)
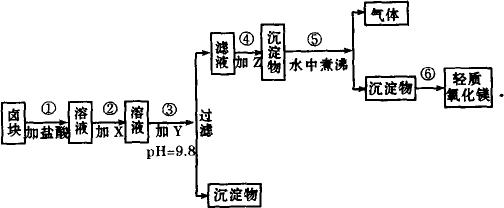
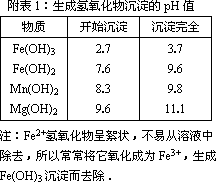
“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”.如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或pH值控制可参考下列附表确定.
请填写以下空白:
(1)在步骤②加入的试剂X,最佳选择应是________,其作用是________.
(2)步骤③加入的试剂Y应是________;之所以要控制pH=9.8,其目的是________.
(3)在步骤⑤时发生的化学反应方程式是________.
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产ZnSO4·6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的pH如下表。
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 8.0 |
题号
1
2
3
4
5
6
7
8
答案
C
C
A
B
C
D
B
A
题号
9
10
11
12
13
14
15
16
答案
B
B
C
D
B
A
C
D

|