
题目列表(包括答案和解析)
完成下列实验探究:
目的:探究氯气通入水中的实质
(一).预测:①________________.
②________________.
③氯气通入水中既有物理变化,又有化学变化
(二).实验设计理思路分析:
(1)如果能证明氯气通入水后,溶液中存在________(填微粒名称)则说明存在物理变化.
(2)如果能证明溶液中除了Cl2分子和H2O分子外,还有________则说明此过程有化学变化.
(三).完成下列实验报告
限选药品和仪器:氯水,镁条,石蕊溶液,AgNO3溶液,红纸条,试管,胶头滴管,砂纸,烧杯,广口瓶,胶塞,导管
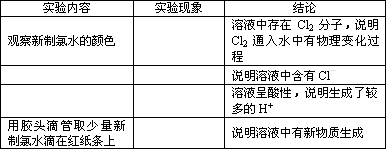
结论:氯气通入水中既有物理变化又有化学变化
(四).反应方程式:________.
(15分)Ⅰ.下列操作或仪器的选用正确的是
![]()

![]() Ⅱ.
Ⅱ.
Ⅱ. 某同学为了探究SO2与Na2O2的反应是否类似于CO2,设计反应装置见下图。
(1)选择制取SO2的合适试剂___________;
a.10%的H2SO4溶液 b.80%的H2SO4溶液 c.Na2SO3固体 d.CaSO3固体
(2)装置C中NaOH溶液的作用是________________;
(3)上述反应装置有些不足之处,为完善该装置,请从供选择的装置中选择需要的装置________(填编号,说明所选装置在整套装置中的位置___________________;
(4)移开棉花,将带火星的木条放在C试管口,木条不复燃,该同学认为SO2与Na2O2的反应不同于CO2,请据此写出反应的化学方程式_________________________;
(5)为检验是否有Na2SO4生成,设计如下方案
![]()

![]()
上述方案________(填“合理”、“不合理”),理由:______________________________;
![]()
(6)Na2O2反应完全后,为确定所得固体的组成,可进行如下操作:称取样品m g并溶于适量的水中,______________(选择下列操作的编号按操作顺序填入),烘干,称量,干燥沉淀质量为n g,计算含量。
a.加足量盐酸酸化的氯化钡溶液 b.加足量硫酸酸化的氯化钡溶液
c.过滤 d.洗涤 e.蒸发结晶





| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.8 | 5.2 |
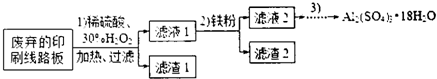
(15分)某探究小组废弃的印刷线路板(含Cu、A1少量Au、Pt等金属的混合物)回收Cu并制备硫酸铝晶体[A12(SO4)3.18H2O],设计路线如下:
(1)过滤时所需要的玻璃仪器有玻璃棒、 、 。
(2)实验时需对滤渣2进行洗涤,判断洗涤是否干净的实验操作方法是 。
(3)为确定加入铁粉的量,实验中需测定滤液1中Cu2+的量。实验操作为:除去H2O2;准确量取一定体积滤液1于带塞锥形瓶中,加水稀释,调节溶液pH=3-4,加入过量KI-淀粉溶液,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式:
①滴定管在注入Na2S2O3标准溶液之前,要先用蒸馏水洗净,再用 。
②滴定终点观察到的现象为 。
③若滴定前溶液中的H2O2没有除尽,所测定的 含量将会 (填“偏高”、“偏
含量将会 (填“偏高”、“偏
低”或“不变”)
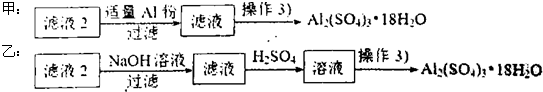
(4)由滤液2制取硫酸铝晶体,探究小组设计了如下二种方案:
甲:
乙:
①操作③的实验步骤依次为:蒸发浓缩: 、 、洗涤。
②从原子利用率角度考虑, 方案更合理。(填“甲”或“乙”)
(5)他们查阅了资料,认为通过先氧化、再调节溶液pH也可将滤液2中的 除去。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1.L-1计算)。
除去。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1.L-1计算)。
| | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| A13+ | 3.8 | 5.2 |
一、二选择题答案
1
2
3
4
5
6
B
D
D
A
C
C
7
8
9
10
11
12
A
C
D
C
D
C
13
14
15
16
17
18
B
C
D
A
D
D
19
20
21
22
23
D
B
C
B
A
三、
24、(7分)
(1) H : O : H (1分)
(2分)3NO2+H2O=2HNO3+NO
Cl2+H2O=HCl+HClO
2Na2O2+2H2O=4NaOH+O2↑
25、(6分)
(1) C 氧原子结构示意图 (每空1分)
 (2)
Al2(SO4)3 (1分) Al3+ +
3H2O
Al(OH)3 +3 H+ (2分) 硫酸或亚硫酸或碳酸(1分)(写出一种即可,合理答案也可)
(2)
Al2(SO4)3 (1分) Al3+ +
3H2O
Al(OH)3 +3 H+ (2分) 硫酸或亚硫酸或碳酸(1分)(写出一种即可,合理答案也可)
26、(8分)
(1)假设2:溶液中存在HCO3-
假设3:溶液中存在CO32-和HCO3-
假设4:溶液中存在CO32-和SO42-
假设5:溶液中存在SO42 、HCO3- (顺序不限。)(各1分)
(2)①用胶头滴管取少量溶液加入试管中,再用滴管取过量的1mol/L氯化钡溶液并滴加到试管A中,充分反应后,静置,然后过滤,将沉淀和滤液分别装入另外的两个试管中(2分);产生白色沉淀。
②往装有沉淀的试管中加入过量的2mol/L盐酸;沉淀部分溶解且有气体生成。说明原溶液中一定含有SO42-和CO32-。
③往装有滤液的试管中加入2mol/L盐酸;出现无色气体,说明原溶液中含有HCO3-。
((每空各1分。其他合理方案参照给分)
27、(13分)(1)不能 (1分) 温度高,水为气态,不利于氨气的生成 (2分)
(2) 25% (2分)K= (1分) 减小 减小 (2分)
(3) C3H3N6 (2分)6CO(NH2)2=6NH3+3CO2+C3H6N6 (2分)
N C N H H (1分)
28、(10分)
(1) 第四周期,第Ⅷ族 (2分)
(2) 3Fe3O4+8Al=9Fe+4Al2O3 (2分) 由来冶炼难熔金属(其他正确答案参照给分)(1分)
Al2O3+2OH-=2AlO2-+H2O (2分)
(3) Cl2+2Fe2+=2Fe3++2Cl- (1分) 3SCN-+Fe3+=Fe(SCN)3 (2分)
29、(15分)
⑴①阳离子交换膜 (2分) ② 2Cu2++4e-=2Cu 4OH-―4e-=2H2O+O2 (各1分)
(2)Cl2+2Br-=Br2+2Cl- (2分) BrO3- 5Br- (各1分)
分液漏斗 烧杯(各1分) ② (1分)
(3)H2S+HDO=HDS+H2O ③H2S(每空2分,共10分)
30、(15分)
(1)B (1分) 第4周期第IB族 (各1分) 1s22s22P63s23P63d104s1或[Ar] 3d104s1 (2分) (2) CO2 、CCl4 (其他合理答案参照给分)(各1分) 分子晶体 原子晶体 (各1分) (3) 7 1 (各1分) (4) IIIA IVA ; b (各1分)
A点所示的氢化物是水,其沸点在氧族元素的氢化物中最高是由于在水分子间存在着氢键,其强度远大于分子间作用力。(1分)
31、(15分)略
(1) (各1分)
(2) (各1分)
(3) (各2分)
(4) 3 3:2:2 (各1分)
(5) (各1分)

 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com