
题目列表(包括答案和解析)

 CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1 CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
| 16 |
| 3 |
| 16 |
| 3 |
 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
 ①温度升高,K值
①温度升高,K值
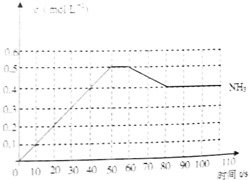
 、
、 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是| c2(NH3) |
| c(N2).c3(H2) |
| c2(NH3) |
| c(N2).c3(H2) |
 哈伯因发明了氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖,N2(g)+3H2(g)
哈伯因发明了氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖,N2(g)+3H2(g)| 催化 |
| 0.52 |
| 2.253×0.75 |
| 0.52 |
| 2.253×0.75 |
(4分)根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4kJ的热量,该反应燃烧的热化学方程式是
____________________________________________________
(2)如图是298 K时N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为:_________________________________。
(4分)根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应燃烧的热化学方程式是
____________________________________________________
(2)如图是298 K时N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为:_________________________________。
1、B 2、A 3、B 4、D 5、B
6、C 7、C 8、B 9、BD 10、B 11、C 12、BD 13、B 14、AD 15、C
16、(8分) ⑴ ②④ (4分,选对一个得2分,错选不给分) ⑵ ①不漏气(1分)②不能确定(1分)
不管装置是否漏气,烧瓶内气压与漏斗上方气压相等,水在重力作用下可流入烧瓶(2分)
17、(14分)(1)H、I、C(或D)、D(或C)、A(或B) (2分)
(2)吸收产生的水蒸气;吸收乙炔中的水蒸气.(每空2分)
(3)
(每空2分)
(4) Ⅰ装置吸收了空气中水和二氧化碳 (每空2分)
18 (10分)(1)
(2) b ; 降低了合成氨反应的活化能
(3) C
⑷ ②③ (每空2分)
19.(12分)(1)H2O(1分) ;在H2O 分子之间存在着氢键的作用(1分)
(2)H++HSO3―=H2O+SO2↑ (2分)
(3) (2分) 离子键、非极性键 (2分)
(4) 阴(1分);2Cl--2e-=Cl2↑(1分);
湿润的淀粉碘化钾试纸(2分)(其他合理答案均可给分);
20(10分)(1)A:S B:H2S D:SO3 (每空1分)
Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O (2分)
(2) A:N2 B:NH3 D:N02 (每空1分)
3Cu+8H++2NO3-=3Cu2++2NO↑十4H20 (2分)
五、
21.(8分)(1)8(2分) (2)C、D(2分,每选一个正确的得1分,错选不给分)
22.(10分,每空2分)
(1)A.CH≡CCH=CH2 E.CH≡CCH2OH
(2)CH2=CHCH=CH2+Br2→CH2BrCH=CHCH2Br
⑶CH≡CH CH2=CH2 CH2Br-CH2Br CH2OH-CH2 OH
(其他合理答案也给分)
六、
23.(8分)
⑴ 439.22L (或439L)(2分) 12.94mol/L (或13mol/L )(2分)
⑵ n(SO2)= (1×104×103L×0.2% )/(22.4 L/mol)=892.86mol
m(NH3)=892.86mol×2×17g/mol = 30357.24 g
∴m(氨水)= 30357.24 g/(25%)×10-6t/g= 0.12吨 (4分)
24.(10分,每空2分,绘图2分)
x取值
y=f(x)
0<x≤3
y=2x/3
3<x<3.2
y=32-10x
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com