
题目列表(包括答案和解析)
向Wg由NaHS、Na2SO3、CuSO4组成的混合物中,加入一定量的水充分反应后过滤.滤液中只含有Na2SO4,滤渣不溶于稀盐酸,且反应过程中无气体逸出.(已知:把H2S通入CuSO4溶液中会发生下列反应:H2S+CuSO4=H2SO4+CuS↓)
(1)滤渣的成分是___________.
(2)原混合物中NaHS、Na2SO3、CuSO4的物质的量之比是______________.
(3)用离子反应方程式表示滤渣的形成过程________________,______________.
硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g)? △H= + 571.2 kJ?mol—1
BaS(s)= Ba(s)+S(s)? △H= +460 kJ?mol—1
已知:2C(s)+O2(g)=2CO(g)? △H= -221 kJ?mol—1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s)? △H= ? ? 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3-=2H3AsO4+3S+10NO2↑+ 2H2O
当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为?? 。
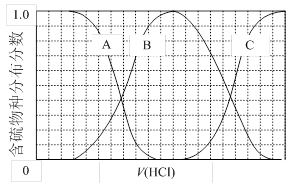
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS—、S2—)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
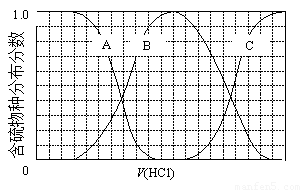
①含硫物种B表示???? 。在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为 ? (填字母)。
a.c(Na+)= c(H2S)+c(HS—)+2c(S2—)
b.2c(Na+)=c(H2S)+c(HS—)+c(S2—)
c.c(Na+)=3[c(H2S)+c(HS—)+c(S2—)]
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是 ? (用离子方程式表示)。
(4)硫的有机物(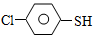 )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
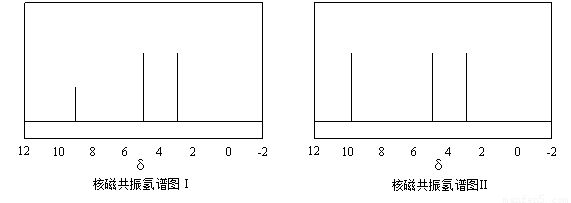
 及X的核磁共振氢谱如下图,其中???? (填“Ⅰ”或“Ⅱ”)为
及X的核磁共振氢谱如下图,其中???? (填“Ⅰ”或“Ⅱ”)为 的核磁共振氢谱图。写出X的结构简式:???? 。
的核磁共振氢谱图。写出X的结构简式:???? 。
硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g) △H=" +" 571.2 kJ?mol—1
BaS(s)= Ba(s)+S(s) △H=" +460" kJ?mol—1
已知:2C(s)+O2(g)=2CO(g) △H=" -221" kJ?mol—1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s) △H= 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3-=2H3AsO4+3S+10NO2↑+ 2H2O
当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为 。
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS—、S2—)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。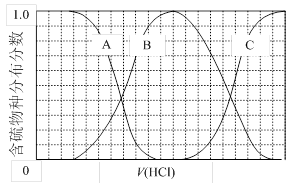
①含硫物种B表示 。在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为 (填字母)。
a.c(Na+)= c(H2S)+c(HS—)+2c(S2—)
b.2c(Na+)=c(H2S)+c(HS—)+c(S2—)
c.c(Na+)=3[c(H2S)+c(HS—)+c(S2—)]
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是 (用离子方程式表示)。
(4)硫的有机物(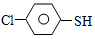 )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。 及X的核磁共振氢谱如下图,其中 (填“Ⅰ”或“Ⅱ”)为
及X的核磁共振氢谱如下图,其中 (填“Ⅰ”或“Ⅱ”)为 的核磁共振氢谱图。写出X的结构简式: 。
的核磁共振氢谱图。写出X的结构简式: 。
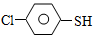 )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。 及X的核磁共振氢谱如下图,其中 (填“Ⅰ”或“Ⅱ”)为
及X的核磁共振氢谱如下图,其中 (填“Ⅰ”或“Ⅱ”)为 的核磁共振氢谱图。写出X的结构简式: 。
的核磁共振氢谱图。写出X的结构简式: 。
1.D 2.B 3.B 4.D 5.A 6.AD 7.D 8.AD 9.A 10.AC 11.AC
12.D 13.BC 14.D 15.C 16.D 17.A 18.B 19.A 20.A 21.C 22.D
23.(1)CuS、S (2)6∶1∶4
(3)

24.(1)D (2)> (3)B
25.解析:(1)
(2)因 中的
中的 ,
, 中的
中的 ,故依电子得失守恒有(x+1)×25.00×0.1000=5×30.00×0.0500,解之,x+2,即
,故依电子得失守恒有(x+1)×25.00×0.1000=5×30.00×0.0500,解之,x+2,即 被氧化成+2价氮的氧化物NO.又因V×C×2=30.00×0.0500×5,故
被氧化成+2价氮的氧化物NO.又因V×C×2=30.00×0.0500×5,故 .依题意知,
.依题意知,


 .所以
.所以 与
与 反应的方程式为
反应的方程式为

 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
26.解析:这是一道天平平衡问题的计算.两个烧杯的质量相等.两个烧杯里盐酸溶液的质量相等.因此论证天平两个烧杯内反应体系质量改变量相等是解决本题的关键.由题意可知:
 溶液增重
溶液增重
100 56
a
 溶液增重
溶液增重
84 40
x 40x/84
当0.3 mol HCl与 恰好完全反应时,消耗
恰好完全反应时,消耗 的质量为:
的质量为: 时;0.3 mol HCl与
时;0.3 mol HCl与 恰好完全反应,消耗
恰好完全反应,消耗 的质量为:0.3×84=
的质量为:0.3×84=
(1)a≤ 、
、 均过量,天平保持平衡的条件是:
均过量,天平保持平衡的条件是:
 x=
x=
(2)a> 不足,且对于
不足,且对于 恰好完全反应时,加入
恰好完全反应时,加入 的烧杯内反应体系的增重量为a-0.15×44,而加入
的烧杯内反应体系的增重量为a-0.15×44,而加入 的烧杯内反应体系的增重量为0.3×40.则天平保持平衡的条件是:
的烧杯内反应体系的增重量为0.3×40.则天平保持平衡的条件是:
a-0.15×44=0.3×40 a=18.6
因此,18.6≥a>15时,天平保持平衡的条件是:
 x=2,
x=2,
(3)当a>18.6时,天平保持平衡的条件是:a-0.15×44=x-0.3×44
x=a+6.6
因为烧杯中无固体剩余,说明a≤15. 、
、 的摩尔质量相当,当等质量的
的摩尔质量相当,当等质量的 、
、 与酸完全反应时,生成
与酸完全反应时,生成 质量相等.所以天平保持平衡时:x=a≤15
质量相等.所以天平保持平衡时:x=a≤15
27.解析:题中涉及化学反应如下: w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
 ①
①
 ②
②
 ③
③
(1)当剩余固体为 ,排出气体为
,排出气体为 、
、 时,因为没有NaOH生成,水未与
时,因为没有NaOH生成,水未与 反应.将方程式①×2+②得:
反应.将方程式①×2+②得:

由方程式可知: .
.
(2)当剩余固体为 、NaOH,排出气体为
、NaOH,排出气体为 、
、 时,由于有NaOH生成,所以有水与
时,由于有NaOH生成,所以有水与 反应.假设反应后无
反应.假设反应后无 生成,将方程式①×2+②+③得:
生成,将方程式①×2+②+③得:

由方程式可知此时 .因为有水生成,所以
.因为有水生成,所以
(3)当 时,由2讨论可知:剩余固体为
时,由2讨论可知:剩余固体为 、NaOH、
、NaOH、 ;排出气体为
;排出气体为 .
.
(4)当排出的 和
和 为等物质的量时,依方程式讨论有:
为等物质的量时,依方程式讨论有:

2b b b

b b 
设反应的 的物质的量为x
的物质的量为x

x x 
依题意有:

所以,反应中消耗 的物质的量为:
的物质的量为: ,用去
,用去 的物质的量为:
的物质的量为:
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
所以,
28.(1)0~50℃时, 不发生分解,固体物质质量不变
不发生分解,固体物质质量不变
(2)50℃~ 分解的结果,结晶水全部失去
分解的结果,结晶水全部失去

179 143

(3)100℃~ 稳定且不发生分解,故固体质量不变
稳定且不发生分解,故固体质量不变
(4)214℃~ 发生了分解
发生了分解

143 55+16x
0.80 0.40
x≈1 y=1.5,
故反应方程式为
(5)280℃~ 反应生成高价态氧化物
反应生成高价态氧化物
 方程式为
方程式为

29.解:假设反应后的混合物标况下仍为气体且体积为 ,由
,由 ,得
,得
 ,可见反应前后物质的量不变,设烷烃为
,可见反应前后物质的量不变,设烷烃为 ,体积为x,则CO为
,体积为x,则CO为
由 体积减少
体积减少

 体积增加
体积增加
 nL (n+1)L
nL (n+1)L 
x

据题意得: nx=
nx=
讨论:(1)n=l时,x=
(2)n=2时,
(3)n=3时,
(4)n=4时,
(5)n≥5时,常温下烷烃不是气态,所以,烷烃可能是 占50%或是:
占50%或是: 占33.3%或:
占33.3%或: 占25%
占25% w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
30.(1)

2 mol 2 mol 2 mol 2 mol
溶液中剩余的水的质量为:
析出小苏打的质量为:
(2) 和
和
当降温至 的质量为:
的质量为:

析出 的质量为:
的质量为:
 共析出晶体的质量为:
共析出晶体的质量为: www.ks5u.com
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com