
题目列表(包括答案和解析)
边微热边向铵明矾[NH3Al(SO4)2·12H2O]溶液中逐滴加入Ba(OH)2溶液至中性.
①此时发生反应的离子方程式为________.
②向以上所得中性溶液中继续滴加Ba(OH)2溶液,这一步离子反应的离子方程式是________.
(14分)
I.常温下浓度均为0.l mol/L的下列溶液:①Na2CO3溶液②NaHCO3溶液③盐酸④氨水
回答下列问题。
(1)上述溶液中有水解反应发生的是 (填编号,下同),溶液中溶质存在电离平衡的是 。
(2)四种溶液中对水的电离抑制作用最大的是 ;比较①、②溶液,pH较大的是 。
(3)在溶液④中加入NH4Cl固体,NH+4浓度与OH-浓度的比值将____(填“变大”、“变小”、“不变”)
II.有一瓶无色澄清溶渡,其中可能含有:NH+4、K+、Mg2+、Al3+、Fe2+、NO-3、Cl-、SO2-4、CO2-3取该溶液进行下列实验:
(1)取部分溶液,向其中逐滴滇入Ba(OH)2溶液至过量,有白色沉淀生成,沉淀量与加入Ba(OH)2溶液量的关系如右图所示。
(2)取(I)反应后过滤所得沉淀和滤液,在沉淀中加入稀盐酸后,沉淀不减少。将滤液分为两等份,一份加热,未产生刺激性气味的气体;另一份如HNO3酸化时有白色沉淀产生,继续加HNO3,沉淀又消失,再加AgNO3没有变化。
根据以上事实确定:该溶液中肯定存在的离子有 ;
肯定不存在的离子有____ 。
(14分)
I.常温下浓度均为0.l mol/L的下列溶液:①Na2CO3溶液②NaHCO3溶液③盐酸④氨水
回答下列问题。
(1)上述溶液中有水解反应发生的是 (填编号,下同),溶液中溶质存在电离平衡的是 。
(2)四种溶液中对水的电离抑制作用最大的是 ;比较①、②溶液,pH较大的是 。
(3)在溶液④中加入NH4Cl固体,NH+4浓度与OH-浓度的比值将____(填“变大”、“变小”、“不变”)
II.有一瓶无色澄清溶渡,其中可能含有:NH+4、K+、Mg2+、Al3+、Fe2+、NO-3、Cl-、SO2-4、CO2-3取该溶液进行下列实验:
(1)取部分溶液,向其中逐滴滇入Ba(OH
 )2溶液至过量,有白色沉淀生成,沉淀量与加入Ba(OH)2溶液量的关系如右图所示。
)2溶液至过量,有白色沉淀生成,沉淀量与加入Ba(OH)2溶液量的关系如右图所示。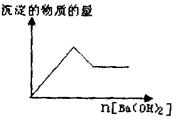
(2)取(I)反应后过滤所得沉淀和滤液,在沉淀中加入稀盐酸后,沉淀不减少。将滤液分为两等份,一份加热,未产生刺激性气味的气体;另一份如HNO3酸化时有白色沉淀产生,继续加HNO3,沉淀又消失,再加AgNO3没有变化。
根据以上事实确定:该溶液中肯定 存在的离子有 ;
存在的离子有 ;
肯定不存在的离子有____ 。
(14分)
I.常温下浓度均为0.l mol/L的下列溶液:①Na2CO3溶液②NaHCO3溶液③盐酸④氨水
回答下列问题。
(1)上述溶液中有水解反应发生的是 (填编号,下同),溶液中溶质存在电离平衡的是 。
(2)四种溶液中对水的电离抑制作用最大的是 ;比较①、②溶液,pH较大的是 。
(3)在溶液④中加入NH4Cl固体,NH+4浓度与OH-浓度的比值将____(填“变大”、“变小”、“不变”)
II.有一瓶无色澄清溶渡,其中可能含有:NH+4、K+、Mg2+、Al3+、Fe2+、NO-3、Cl-、SO2-4、CO2-3取该溶液进行下列实验:
(1)取部分溶液,向其中逐滴滇入Ba(OH)2溶液至过量,有白色沉淀生成,沉淀量与加入Ba(OH)2溶液量的关系如右图所示。

(2)取(I)反应后过滤所得沉淀和滤液,在沉淀中加入稀盐酸后,沉淀不减少。将滤液分为两等份,一份加热,未产生刺激性气味的气体;另一份如HNO3酸化时有白色沉淀产生,继续加HNO3,沉淀又消失,再加AgNO3没有变化。
根据以上事实确定:该溶液中肯定存在的离子有 ;
肯定不存在的离子有____ 。
I.常温下浓度均为0.l mol/L的下列溶液:①Na2CO3溶液②NaHCO3溶液③盐酸④氨水
回答下列问题。
(1)上述溶液中有水解反应发生的是 (填编号,下同),溶液中溶质存在电离平衡的是 。
(2)四种溶液中对水的电离抑制作用最大的是 ;比较①、②溶液,pH较大的是 。
(3)在溶液④中加入NH4Cl固体,NH+4浓度与OH-浓度的比值将____(填“变大”、“变小”、“不变”)
II.有一瓶无色澄清溶渡,其中可能含有:NH+4、K+、Mg2+、Al3+、Fe2+、NO-3、Cl-、SO2-4、CO2-3取该溶液进行下列实验:
(1)取部分溶液,向其中逐滴滇入Ba(OH)2溶液至过量,有白色沉淀生成,沉淀量与加入Ba(OH)2溶液量的关系如右图所示。

(2)取(I)反应后过滤所得沉淀和滤液,在沉淀中加入稀盐酸后,沉淀不减少。将滤液分为两等份,一份加热,未产生刺激性气味的气体;另一份如HNO3酸化时有白色沉淀产生,继续加HNO3,沉淀又消失,再加AgNO3没有变化。
根据以上事实确定:该溶液中肯定存在的离子有 ;
肯定不存在的离子有____ 。
1.C 2.C 3.D 4.B 5.B 6.A 7.AD 8.AC 9.BD 10.AC 11.C
12.D 13.AC 14.D 15.B 16.D 17.B 18.B 19.A 20.D 21.D 22.B
23.(1) ;
; ;生成了弱电解质
;生成了弱电解质 ,破坏了
,破坏了 的溶解平衡.
的溶解平衡.
(2)①


②
24.(1) 在溶液中存在
在溶液中存在 的电离,
的电离,

 ,同时还存在
,同时还存在 离子的水解,
离子的水解,

 ,
, 溶液呈弱碱性,说明
溶液呈弱碱性,说明 的水解反应占优势.
的水解反应占优势.
(2) 在溶液中存在着
在溶液中存在着 离子的电离,同时又存在
离子的电离,同时又存在 离子的水解,
离子的水解, 呈弱酸性说明
呈弱酸性说明 离子的电离比水解来得强.
离子的电离比水解来得强.
(3)
25.A: B:
B: C:
C: D:
D: E:
E:
① ②
② ③
③
④
26.(1)粉红 


(2)放出气体,溶液变浑浊,红色加深红

27.(1)溶液变成紫红色,0.25 (2) ,
, w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
28.(1)硫 (2) ;
;
(3) ,可能含有
,可能含有 (4)
(4) 、
、 、
、 、
、 和
和 、
、 和
和
(5) 、
、 、
、
29.解析:①溶液中 被完全沉淀出后,
被完全沉淀出后, 才开始沉淀.图中曲线第二段为平行直线,沉淀总物质的量没有增减.故这段是因
才开始沉淀.图中曲线第二段为平行直线,沉淀总物质的量没有增减.故这段是因 的溶解和
的溶解和 的继续生成导致,且溶解的
的继续生成导致,且溶解的 的物质的量和生成的
的物质的量和生成的 物质的量相等.故加入的物质:
物质的量相等.故加入的物质:
 这段的离子方程式为:
这段的离子方程式为:


②第一段生成的沉淀为 、
、 和
和 ,且B为90 mL时,
,且B为90 mL时, 、
、 恰好沉淀完全.这段反应的离子方程式为:
恰好沉淀完全.这段反应的离子方程式为: ,
,
 ,
,
③图中曲线第三段(100-110 mL),B为100 mL时 恰好沉淀完全.这段中
恰好沉淀完全.这段中 继续溶解,B为110 mL时,沉淀中
继续溶解,B为110 mL时,沉淀中 已完全溶解.这段中溶解了
已完全溶解.这段中溶解了 ,消耗了10 mL NaOH,故
,消耗了10 mL NaOH,故 ,则100 mL时,共加入
,则100 mL时,共加入 为0.1 mol,共生成
为0.1 mol,共生成 ,故A溶液中
,故A溶液中 .这段
.这段 溶解的离子方程式为:
溶解的离子方程式为:
④图中曲线第四段中,沉淀为 、
、 共0.11 mol,则
共0.11 mol,则
 为0.11 mol,A中
为0.11 mol,A中 .
.
⑤第二、三段间共消耗 ,则共溶解的
,则共溶解的 为0.02 mol,则A中
为0.02 mol,则A中 .w.w.w.k.s.5.u.c.o.m
.w.w.w.k.s.5.u.c.o.m
30.(1) ;
;
(2) ;
; ;
; ,
,

(3) ;
; ;
; ,
,
(4) ;
;
(5)
(6)
 www.ks5u.com
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com