
题目列表(包括答案和解析)
A.2∶1 B.5∶1
C.3∶2 D.1∶1
(15分)
在常温下,某水溶液M中。
(1)若M中存在的离子只有:Na+、CH3COO-、H+、OH-,下列关系合理的是 。
① c(Na+)>c(CH3COO-)>c(OH-)>c(H+) ② c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
③ c(H+)>c(OH-)>c(Na+)>c(CH3COO-) ④ c(Na+)=c(CH3COO-)且c(OH-)=c(H+)
(2)若M由两种相同物质的量浓度的溶液混合而成,其中只存在OH—、H+、NH4+、Cl-四种离子,且c(NH4+)>c(Cl-)>c(OH—)>c(H+),这两种溶液的溶质是 。
(3)若M为0.01 mol/L的氨水,向其中加入等体积pH=2的盐酸溶液(忽略溶液体积变化),所得混合液中:c(NH4+)+c(H+)-c(OH-)= 。
(4)若M为20 mL稀硫酸和盐酸混合液,向该混合酸溶液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如图所示,当加入60 mLBa(OH)2溶液时,C点溶液的pH=7(忽略溶液体积变化),试计算:
(i)最初混合酸溶液中c(H2SO4)=__________,c(HCl)=____________。
(ii)B点溶液的pH为多少?(写出计算过程。可能用到的数据:1g2=0.30、1g3=0.48)
(15分)
在常温下,某水溶液M中。
(1)若M中存在的离子只有:Na+、CH3COO-、H+、OH-,下列关系合理的是 。
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+) ②c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
③c(H+)>c(OH-)>c(Na+)>c(CH3COO-) ④c(Na+)=c(CH3COO-)且c(OH-)=c(H+)
(2)若M由两种相同物质的量浓度的溶液混合而成,其中只存在OH—、H+、NH4+、Cl-四种离子,且c(NH4+)>c(Cl-)>c(OH—)>c(H+),这两种溶液的溶质是 。
(3)若M为0.01 mol/L的氨水,向其中加入等体积pH=2的盐酸溶液(忽略溶液体积变化),所得混合液中:c(NH4+)+c(H+)-c(OH-)= 。
(4)若M为20 mL稀硫酸和盐酸混合液,向该混合酸溶液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如图所示,当加入60 mL Ba(OH)2溶液时,C点溶液的pH=7(忽略溶液体积变化),试计算:
(i)最初混合酸溶液中c(H2SO4)=__________,c(HCl)=____________。
(ii)B点溶液的pH为多少?(写出计算过程。可能用到的数据:1g2=0.30、1g3=0.48)
(15分)
在常温下,某水溶液M中。
(1)若M中存在的离子只有:Na+、CH3COO-、H+、OH-,下列关系合理的是 。
① c(Na+)>c(CH3COO-)>c(OH-)>c(H+) ② c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
③ c(H+)>c(OH-)>c(Na+)>c(CH3COO-) ④ c(Na+)=c(CH3COO-)且c(OH-)=c(H+)
(2)若M由两种相同物质的量浓度的溶液混合而成,其中只存在OH—、H+、NH4+、Cl-四种离子,且c(NH4+)>c(Cl-)>c(OH—)>c(H+),这两种溶液的溶质是 。
(3)若M为0.01 mol/L的氨水,向其中加入等体积pH=2的盐酸溶液(忽略溶液体积变化),所得混合液中:c(NH4+)+c(H+)-c(OH-)= 。
(4)若M为20 mL稀硫酸和盐酸混合液,向该混合酸溶液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如图所示,当加入60 mL Ba(OH)2溶液时,C点溶液的pH=7(忽略溶液体积变化),试计算:

(i)最初混合酸溶液中c(H2SO4)=__________,c(HCl)=____________。
(ii)B点溶液的pH为多少?(写出计算过程。可能用到的数据:1g2=0.30、1g3=0.48)
在常温下,某水溶液M中。
(1)若M中存在的离子只有:Na+、CH3COO-、H+、OH-,下列关系合理的是 。
① c(Na+)>c(CH3COO-)>c(OH-)>c(H+) ② c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
③ c(H+)>c(OH-)>c(Na+)>c(CH3COO-) ④ c(Na+)=c(CH3COO-)且c(OH-)=c(H+)
(2)若M由两种相同物质的量浓度的溶液混合而成,其中只存在OH—、H+、NH4+、Cl-四种离子,且c(NH4+)>c(Cl-)>c(OH—)>c(H+),这两种溶液的溶质是 。
(3)若M为0.01 mol/L的氨水,向其中加入等体积pH=2的盐酸溶液(忽略溶液体积变化),所得混合液中:c(NH4+)+c(H+)-c(OH-)= 。
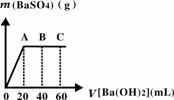 (4)若M为20 mL稀硫酸和盐酸混合液,向该混合酸溶液
(4)若M为20 mL稀硫酸和盐酸混合液,向该混合酸溶液
中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量
如右图所示,当加入60 mL Ba(OH)2溶液时,C点溶液
的pH=7(忽略溶液体积变化),试计算:
(i)最初混合酸溶液中c(H2SO4)=__________,c(HCl)=____________。
(ii)B点溶液的pH为多少?(写出计算过程。可能用到的数据:1g2=0.30、1g3=0.48)
1.C 2.C 3.D 4.B 5.B 6.A 7.AD 8.AC 9.BD 10.AC 11.C
12.D 13.AC 14.D 15.B 16.D 17.B 18.B 19.A 20.D 21.D 22.B
23.(1) ;
; ;生成了弱电解质
;生成了弱电解质 ,破坏了
,破坏了 的溶解平衡.
的溶解平衡.
(2)①


②
24.(1) 在溶液中存在
在溶液中存在 的电离,
的电离,

 ,同时还存在
,同时还存在 离子的水解,
离子的水解,

 ,
, 溶液呈弱碱性,说明
溶液呈弱碱性,说明 的水解反应占优势.
的水解反应占优势.
(2) 在溶液中存在着
在溶液中存在着 离子的电离,同时又存在
离子的电离,同时又存在 离子的水解,
离子的水解, 呈弱酸性说明
呈弱酸性说明 离子的电离比水解来得强.
离子的电离比水解来得强.
(3)
25.A: B:
B: C:
C: D:
D: E:
E:
① ②
② ③
③
④
26.(1)粉红 


(2)放出气体,溶液变浑浊,红色加深红

27.(1)溶液变成紫红色,0.25 (2) ,
, w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
28.(1)硫 (2) ;
;
(3) ,可能含有
,可能含有 (4)
(4) 、
、 、
、 、
、 和
和 、
、 和
和
(5) 、
、 、
、
29.解析:①溶液中 被完全沉淀出后,
被完全沉淀出后, 才开始沉淀.图中曲线第二段为平行直线,沉淀总物质的量没有增减.故这段是因
才开始沉淀.图中曲线第二段为平行直线,沉淀总物质的量没有增减.故这段是因 的溶解和
的溶解和 的继续生成导致,且溶解的
的继续生成导致,且溶解的 的物质的量和生成的
的物质的量和生成的 物质的量相等.故加入的物质:
物质的量相等.故加入的物质:
 这段的离子方程式为:
这段的离子方程式为:


②第一段生成的沉淀为 、
、 和
和 ,且B为90 mL时,
,且B为90 mL时, 、
、 恰好沉淀完全.这段反应的离子方程式为:
恰好沉淀完全.这段反应的离子方程式为: ,
,
 ,
,
③图中曲线第三段(100-110 mL),B为100 mL时 恰好沉淀完全.这段中
恰好沉淀完全.这段中 继续溶解,B为110 mL时,沉淀中
继续溶解,B为110 mL时,沉淀中 已完全溶解.这段中溶解了
已完全溶解.这段中溶解了 ,消耗了10 mL NaOH,故
,消耗了10 mL NaOH,故 ,则100 mL时,共加入
,则100 mL时,共加入 为0.1 mol,共生成
为0.1 mol,共生成 ,故A溶液中
,故A溶液中 .这段
.这段 溶解的离子方程式为:
溶解的离子方程式为:
④图中曲线第四段中,沉淀为 、
、 共0.11 mol,则
共0.11 mol,则
 为0.11 mol,A中
为0.11 mol,A中 .
.
⑤第二、三段间共消耗 ,则共溶解的
,则共溶解的 为0.02 mol,则A中
为0.02 mol,则A中 .w.w.w.k.s.5.u.c.o.m
.w.w.w.k.s.5.u.c.o.m
30.(1) ;
;
(2) ;
; ;
; ,
,

(3) ;
; ;
; ,
,
(4) ;
;
(5)
(6)
 www.ks5u.com
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com