
题目列表(包括答案和解析)
A.FeO B.Fe3O4 C.Fe4O5 D.Fe5O7
某铁的氧化物,用7 mol•L-1的盐酸100 mL在一定条件下恰好完全溶解,所得溶液再通入0.56 L(标准状况下)的氯气时,刚好使溶液中Fe2+完全转化为Fe3+。则该氧化物的化学式可表示为( )
A. FeO B. Fe3O4 C. Fe4O5 D.Fe5O7
A. FeO B. Fe3O4 C. Fe4O5 D.Fe5O7
|
某铁的氧化物,用7 mol·L-l的盐酸100 mL在一定条件下恰好完全溶解,所得溶液再通入0.56 L标准状况下的氯气时,刚好使溶液中Fe2+完全转化为Fe3+.则该氧化物的化学式可表示为 | |
| [ ] | |
A. |
FeO |
B. |
Fe3O4 |
C. |
Fe4O5 |
D. |
Fe5O7 |
(15分)某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O 晶体。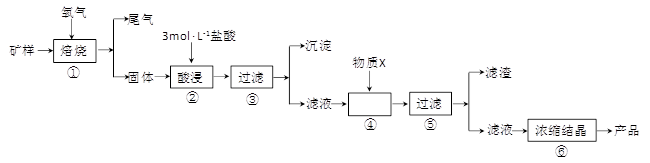
已知:常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
| 金属离子 | 氢氧化物开始沉淀的pH | 氢氧化物沉淀完全的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |

1.B 2.C 3.C 4.B 5.B 6.C 7.C 8.B 9.C 10.AC 11.AD 12.D
13.B 14.A 15.B 16.D 17.B 18.B 19.D 20.D 21.C 22.C
23.(1) ;
; ;(2)HCl;
;(2)HCl; ;(3)HCl、
;(3)HCl、 、
、
24.(1) 、
、 、
、 ;(2)铁粉,Ag (3)
;(2)铁粉,Ag (3) 、
、 、
、 、
、 ;
;
25.D的式量比C大16,猜想Y是 .
. 的连锁反应中,中心元素的价态接连升高,且可能出现一种这样的中心元素,猜想中心元素是硫或氮.
的连锁反应中,中心元素的价态接连升高,且可能出现一种这样的中心元素,猜想中心元素是硫或氮.
正盐A既能与强酸反应,又能跟强碱反应,且生成硫或氮的化合物,说明A是弱酸的铵盐
(1)

 (2)
(2) (3)
(3)
(4) 或
或
26.(1)Fe、C、Si、Al (2)Fe、C  、
、
 、
、
 、
、
(3)
(4)

27.(1)Mg  C
C  MgO CO (2)
MgO CO (2) Fe
Fe 



(3) ,
,

 ,
,
29.(1) (2)设金属元素的原子量为x
(2)设金属元素的原子量为x

x+16 44
 x=40,该金属元素是Ca,氧化物E的化学式是CaO
x=40,该金属元素是Ca,氧化物E的化学式是CaO
(3) ,设G的分子量为y,则
,设G的分子量为y,则 ,y=44,若G
,y=44,若G
分子中含有1个O原子,则44-16=28,28是N原子量的2倍,则G是 ,若G分子中含2个O原子,则44-32=12,则G是
,若G分子中含2个O原子,则44-32=12,则G是 ,不合题意
,不合题意
(4) ,
,
30.(1)由于向溶液中滴加盐酸,无现象,再滴加 溶液,产生白色沉淀.所以,R必定是硫酸根;R的化学式为
溶液,产生白色沉淀.所以,R必定是硫酸根;R的化学式为
(2)



b+34 18 18
解得 b=24,∴ B是镁元素

x∶y∶z=0.01∶0.01∶0.06=l∶1∶6
∴ x=1;y=1;z=6
(3)A的原子量为 ,∴ A是钾元素
,∴ A是钾元素
A元素的名称是钾
(4)复盐的化学式为
(5)焰色反应 www.ks5u.com
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com