
题目列表(包括答案和解析)
(10分)工业上以锂辉石(,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:①
②某些物质的溶解度()如下表所示。
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣1中分离出A12O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤II中反应的离子方程式是 。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述) 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是 。
②b中,生成Li2CO3反应的化学方程式是 。
(10分)工业上以锂辉石(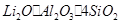 ,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:

已知:①
②某些物质的溶解度(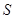 )如下表所示。
)如下表所示。
|
T/℃ |
20 |
40 |
60 |
80 |
|
S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
|
S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出A12O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤II中反应的离子方程式是 。
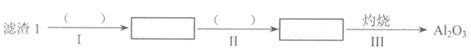
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述) 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是 。
②b中,生成Li2CO3反应的化学方程式是 。
(9分)某同学对第四周期过渡元素产生浓厚的兴趣。想探究是否只有MnO2能催化KClO3受热分解?CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解有没有催化作用?若有催化作用,效率怎样?请你与他一起进行实验探究:
I.课题名称:_________________________。
Ⅱ.实验仪器:略
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
Ⅲ.实验步骤:略
Ⅳ.实验数据:
|
实验 编号 |
KClO3 (g) |
氧化物 |
产生气体(mL) (已折算为标况) |
耗时(s) |
||
|
化学式 |
质量(g) |
回收 |
||||
|
1 |
0.6 |
— |
— |
— |
10 |
480 |
|
2 |
0.6 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.6 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.6 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.6 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
V.实验讨论:
⑴请用编号3的实验数据求得KClO3的分解率:为______%(保留一位小数)。
⑵在用Cr2O3做实验时,有刺激性气味的气体产生,同时绿色的混合物变成橘黄色(K2Cr2O7)。该刺激性气体可能是______(填化学式),用 检验。(填序号)
A、湿润的蓝色石蕊试纸 B、湿润的碘化钾淀粉试纸
C、湿润的PH试纸 D、湿润的红色石蕊试纸
Ⅵ.实验结论:________________________________________________________。
(9分)某同学对第四周期过渡元素产生浓厚的兴趣。想探究是否只有MnO2能催化KClO3受热分解?CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解有没有催化作用?若有催化作用,效率怎样?请你与他一起进行实验探究:
I.课题名称:_________________________。
Ⅱ.实验仪器:略
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
Ⅲ.实验步骤:略
Ⅳ.实验数据:
| 实验 编号 | KClO3 (g) | 氧化物 | 产生气体(mL) (已折算为标况) | 耗时(s) | ||
| 化学式 | 质量(g) | 回收 | ||||
| 1 | 0.6 | — | — | — | 10 | 480 |
| 2 | 0.6 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.6 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.6 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.6 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
V.实验讨论:
⑴请用编号3的实验数据求得KClO3的分解率:为______%(保留一位小数)。
⑵在用Cr2O3做实验时,有刺激性气味的气体产生,同时绿色的混合物变成橘黄色(K2Cr2O7)。该刺激性气体可能是______(填化学式),用 检验。(填序号)
A、湿润的蓝色石蕊试纸 B、湿润的碘化钾淀粉试纸
C、湿润的PH试纸 D、湿润的红色石蕊试纸
Ⅵ.实验结论:________________________________________________________。
10 ℃时各物质的溶解度
NaNO3 | NaCl | KNO3 | KCl |
80 g | 35.8 g | 20.9 g | 31 g |
A.混合溶液中无任何晶体析出
B.混合溶液中有KNO3、NaCl两种晶体同时析出
C.混合溶液中只有NaCl晶体析出
D.混合溶液中只有KNO3晶体析出
说明:1. 文字简答题以关键词到位为准,按点给分;
2. 化学用语书写:(1)方程式未配平不得分、无条件扣一半分值;
(2)化学式书写错误得0分;
3. 写名称或化学式正确的正常给分; 4. 其他合理解法正常给分。
第Ⅰ卷(选择题,共48分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
C
D
A
D
C
B
B
C
CD
B
CD
B
AD
A
第Ⅱ卷(非选择题 共72分)
三、(本题包括2小题,共22分)
15.(6分)(1)镁条表面产生气泡(2分)(2)A,B或C或D(2分,各1分)
(3)Mg+Cu2++2H2O=Mg2++Cu(OH)2↓+H2↑ Mg+Cu2+= Mg2++Cu (各1分,共2分)
16.(16分)(1)烧杯、玻璃棒,过滤,换过滤器并重新进行过滤操作(4分,每空1分)
(2)NaOH、Na2CO3(2分) (3)NaOH C (2分,各1分)
(4)除去NaOH和Na2CO3(2分) (5)蒸发皿,蒸发皿中有大量固体析出(2分,各1分)
(6)加快沉淀生成 5.61×10―8 mol?L―1。(4分,各2分)
四、(本题包括2小题,共18分)
17.(8分)(1)小,工业制备硫酸。 (2)MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O。
使Fe2+ 转变为Fe3+,Fe3+完全沉淀的pH较低(或Fe3+更易沉淀)。
(3)与溶液中的酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀。
(4)使MnCO3沉淀完全。MnCO3沉淀量少,NH4HCO3与酸反应。
(或MnCO3、NH4HCO3与酸反应溶解)
(5)节约能源、治理含SO2的工业废气等。(答对1个即可)(每空1分)
18.(10分)(1)接触室,防止催化剂中毒。(各1分,共2分)
(2)SO2+V2O5 SO3+ V2O4 4VOSO4+O2
SO3+ V2O4 4VOSO4+O2 2V2O5+4SO3(各1分,共2分)
2V2O5+4SO3(各1分,共2分)
(3)400 L?mol―1,使用常压SO2就可以达到较高的转化率。(前者2分,后者1分,共3分)
(4)①②,V2O5+ SO32―+4H+=2VO2++SO42―+2H2O。4和80℃。(各1分,共3分)
五、(本题包括1小题,共14分)
19.(14分)(1)4(2分)
(2) (2分)
(2分) (2分)
(2分)
(3)保护醛基不被还原。(2分)
(4)RCHO + 2Ag(NH3)2+
+ 2OH-  RCOO― +NH4+ +2Ag↓+3NH3 + H2O
(2分)
RCOO― +NH4+ +2Ag↓+3NH3 + H2O
(2分)
(5)(4分,对1步给2分,对2步给3分,全对给4分)

六、(本题包括1小题,共8分)
20.(8分)解:(1)6Fe2++ClO3-+6H+===6Fe3++Cl-+3H2O (2分)
(2)n(Fe)=2.80g/160g?mol-1×2=0.035mol
n(SO42-)=10.48 g /233 g?mol-1=0.045mol
n(OH-)=3×n(Fe)-2×n(SO42-)=3×0.035-2×0.045=0.015mol (2分)
盐基度=n(OH-)/3n(Fe)×100%
= 0.015 mol/(3×0.035 mol) ×100%
=14.29% (2分)
(3)n(H2O)=(7.51g―0.035mol×56g?mol -1-0.045mol×96 g?mol-1-0.015mol×17 g?mol-1)/18 g?mol-1=0.054 mol
化学式: Fe35(OH)15(SO4)45?54H2O (2分)
七、选做题(下面两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果你两题全做,按第一题评分。每题均为10分。)
22. (A) (1)第四周期,第Ⅷ族 (1分) (2)CN― C22- sp3 液态氨汽化时需吸收大量的热 2 (各1分,共4分)
(3) [Ar]3d7;或 (1分)2NiO(OH) + 6HCl(浓)=2NiCl2+Cl2↑+4H2O;(1分)
(1分)2NiO(OH) + 6HCl(浓)=2NiCl2+Cl2↑+4H2O;(1分)
(4)x=5(1分) LaNi5H6+6OH- -6e-==LaNi5+6H2O (2分)
21.(B)22(B)(1)固定试管(2分) 容量瓶 酸式滴定管 烧杯(共2分,答对1-2个给1分,全对给2分)
(2)Al2O3 + 2NaOH =2NaAlO2 +H2O, 作用:去除铝箔表面的氧化膜 2Al + 3HgCl2 =2AlCl3 + 3Hg ,Al + Hg =Al (Hg) (铝汞齐), 作用:形成铝汞齐破坏致密氧化膜的形成(共2分)
(3)打开橡皮塞,用火柴点燃,出现轻微“噗”声或尖锐爆鸣声皆能说明有H2生成。(2分)
(4)原因分别是:浓硫酸具有吸水性,溢出后吸收空气的水变成稀硫酸,而稀硫酸与铝的氧化膜及铝本身皆发生反应;浓硝酸具有挥发性,溢出后因挥发同样会变稀,变稀的硝酸与氧化膜及铝本身亦发生反应。(各1分,2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com