
题目列表(包括答案和解析)
 (2009?深圳二模)甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段:
(2009?深圳二模)甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段:| 10min | 20min | 30min | 40min | 50min | 60min | |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |

| 时间浓度(mol/L)温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
 甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段制备甲醇:
甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段制备甲醇:| 10min | 20min | 30min | 40min | 50min | 60min | |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
| 1 |
| 2 |
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
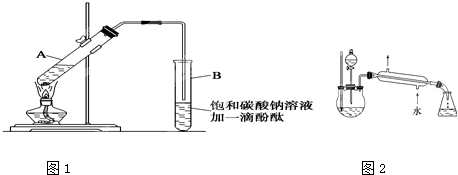
| 浓硫酸 |
| 加热 |
| 浓硫酸 |
| 加热 |
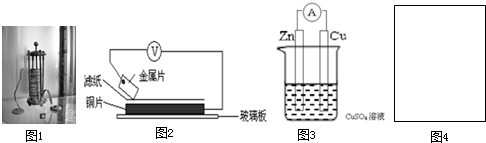
| 金属 | 电子流动方向 | 电压(V) |
| A | A→Cu | +0.78 |
| B | Cu→B | -0.15 |
| D | D→Cu | +1.35 |
| E | E→Cu | +0.30 |
 ”代表反应容器,“
”代表反应容器,“ ”代表导线,“
”代表导线,“ ”代表电极,“
”代表电极,“ ”代表小灯泡,在右侧方框(图4)内画出装置图并指出电极材料和电解质溶液,标出电源的正负极.
”代表小灯泡,在右侧方框(图4)内画出装置图并指出电极材料和电解质溶液,标出电源的正负极.第Ⅰ卷(选择题共74分)
一.二选择题:
题号
1
2
3
4
5
6
7
8
答案
C
D
A
B
C
B
B
C
题号
9
10
11
12
13
14
15
16
17
18
答案
C
AC
BC
C
B
D
D
C
B、C
C
第Ⅱ卷(选择题共76分)
19.(1)AEF (2)AB (3)AF(或AE) (4)D
(5)安全瓶防止碱液倒吸 (2分×5)
20.(1)C(1分), B (1分)
(2)B(1分) 负极:2Cu-4e- =2Cu2+ (2分) 正极:2H2O+O2+4e- ==4OH-(2分)
21.离子方程式(略)(1)、(3);(1)中F-还原性很弱,不能使Fe3+还原为Fe2+;
(3)中F-不与SCN-反应,SCN-没有被消耗,所以当再加入足量的FeCl3溶液时,溶液又呈血红色。 (2分×3)
22.(1)弱电解质
(2)H5IO6
5 H5IO6 + 2Mn2+ = 11 H+ +2 MnO4― + 5 IO3― + 7 H2O (2分×3)
23.(1)山坡上;(2)碳酸钠溶液或碳酸氢钠溶液浸湿毛巾;
(3)肥皂水(或洗衣粉)浸湿毛巾;
(4)氢氧化钠溶液或者氢氧化钙溶液;
(5)浓氨水。(2分×5)[其它合理答案也可]
24.(1)A:H2S D:H2SO4 2H2S+3O2 == 2SO2+2H2O;
(2)A:NH3 4NH3+5O2 == 4NO + 6H2O
(3)三、ⅠA族、略
(4)S 2SO2+O2 2SO3;C(略); N2 2NO+O2==2NO2
2SO3;C(略); N2 2NO+O2==2NO2
[(1)、(2)方程式2分,其它各1分,以上条件略写出,但评分时要斟情扣分]
25.(1)NH4Cl ,①;(2)NH4Cl 和NH3?H2O(过量), NH4Cl 和HCl(过量)
(3)小于 ,大于 (1分×6)
26.解答:(1)AB (2分)(2)除去过量的铁屑(1分)(3) Fe2(SO4)3 ;废铁屑中含有氧化生成Fe2O3(或Fe3O4)被H2SO4溶解生成Fe2(SO4)3。FeSO4被空气氧化生成Fe2(SO4)3;取少许滤液,加KSCN溶液,观察溶液是否变血红色。(3分)
(4)解法一:若反应后得到的FeSO4在
x= ==34.17(mL)<50mL
==34.17(mL)<50mL
所以,蒸发后溶液尚未饱和. (3分)
解法二:若该溶液是饱和的,则其所含的 FeSO4溶质的质量为y 则
y==50×1.36× ==22.24(g)
==22.24(g)
按题意 H2SO4完全反应得到的 FeSO4的质量为:
0.5 × 200 ×10-3 ×152 =15.2
因
(5)C;(4)中求证
(
(6)(3分)解法一:
①(5)中所给
50.0ml ×
②设析出的FeSO4?7H2O的质量为X,则可列出
 =
= x=
x=
解法二:
 ×100%=17.0%
×100%=17.0%
则(50.0×1.30-x)× +
x×
+
x× =15.2
=15.2
x=11.0 (g)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com