
题目列表(包括答案和解析)
下述是某反应的微观示意图,若用“●”表示氢原子,用“○”表示氧原子,用“![]() ”表示硫原子。
”表示硫原子。
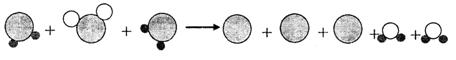
(1)写出该反应的化学方程式______________________________。
(2)上述参加反应的两种物质均是无色气体,若将这两瓶气体充分混合,推测出现的现象是有黄色固体生成、______________________________。
(3)由上述微观示意图也可看出,化学反应前后不发生变化的有____________________。
下述是某反应的微观示意图,若用“ ”表示氢原子,用“ ”表示氧原子,用“ ”表示硫原子。
 |
(1)写出该反应的化学方程式: 。
(2)上述参加反应的两种物质均是无色气体,若将这两瓶气体充分混合,推测出现的现象是有黄色固体生成、 。
(3)由上述微观示意图也可看出,化学反应中不发生变化的有
。
“旺旺雪饼”内有一个小纸袋,上面写着“干燥剂,主要成分是生石灰。”
(1)生石灰(CaO)可作干燥剂的理由(用化学方程式表示)______________________;
(2)化学活动小组欲探究该干燥剂变质后还可能存在的物质(除CaO和上述反应的生成物)。请你也参与这次探究活动,并完成下列实验报告。
| 猜想 | 实验步骤 | 实验现象 | 实验结论 |
| 猜想干燥剂变质后还可能存在的物质是______。 |
(3)现已研究成功在食品中放入一小包被称为“双吸剂”的物质。用来吸收氧气和水分,以防止食品腐败。根据你所学过的知识,写出这种“双吸剂”的可能成分。
(5分)钢铁的冶炼是人类文明的一个重要标志。图1是实验室模拟炼铁的装置图。
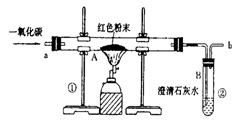


图一 图二 图三
(1)写出图1中A处发生的化学反应方程式: ;
(2)实验过程中通入CO质量与红色粉末质量的关系如图2所示。根据图示,下列说法不正确的是 ;(填序号)
①a点表示开始通入CO,反应开始发生
②b点表示通入CO一段时间后加热,反应开始发生
③c点表示红色粉末已充分参加反应
④d点表示反应结束后仍需继续通入CO
⑤可根据通入CO的质量计算出红色粉末的质量
(3)图1装置中的不足之处是 。
(4)该实验炼制的铁与工业炼制出的铁最大的区别是 。
(5)某化学小组的同学们利用上述实验对一份固体样品进行了探究。通过实验已确定该样品由氧化铁和铁粉混合而成。他们取了3.6g固体样品,用图1所示的装置重新实验,测定的部分数据如图3所示,则原样品中铁元素与氧元素的质量比是 。
一、选择题(单选,每题1分,共40分)。
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
答案
A
D
A
D
D
C
B
D
C
C
D
B
A
A
C
D
D
A
A
D
题号
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
答案
A
C
A
B
D
C
A
D
B
B
D
B
C
C
B
C
B
B
C
B
二、填空题。(共包括6道小题,共30分)
41.(4分)(1)氮气;混合物.
/2009年北京市大兴区第一学期期末检测初三化学.files/image051.gif) |
|