
题目列表(包括答案和解析)
用浓度为0.10 mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,其实验步骤如下:
I、滴定前的准备:
① → 用蒸馏水清洗 → 用待装溶液润洗 → 装液→ ② → 调节液面在零刻度或零刻度以下 → 记录初始读数
II、滴定:
分别取20.00 mL 草酸溶液于4个洁净的锥形瓶中,滴加几滴MnSO4溶液,然后用标准的KMnO4(H+)溶液进行滴定至终点,记录最终读数。数据如下:
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 初始读数(mL) | 0.40 | 0.10 | 0.90 | 0.00 |
| 最终读数(mL) | 25.05 | 20.10 | 21.00 | 19.90 |
| V标(mL) | 24.65 | 20.00 | 20.10 | 19.90 |
用浓度为0.10 mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,其实验步骤如下:
I、滴定前的准备:
① → 用蒸馏水清洗 → 用待装溶液润洗 → 装液→ ② → 调节液面在零刻度或零刻度以下 → 记录初始读数
II、滴定:
分别取20.00 mL 草酸溶液于4个洁净的锥形瓶中,滴加几滴MnSO4溶液,然后用标准的KMnO4(H+)溶液进行滴定至终点,记录最终读数。数据如下:
|
测定次序 |
第一次 |
第二次 |
第三次 |
第四次 |
|
初始读数(mL) |
0.40 |
0.10 |
0.90 |
0.00 |
|
最终读数(mL) |
25.05 |
20.10 |
21.00 |
19.90 |
|
V标(mL) |
24.65 |
20.00 |
20.10 |
19.90 |
III、实验数据处理:略
请回答下列问题:
(1)将步骤I中的操作补充完整:
①__________________________
②__________________________
(2)KMnO4(H+)溶液应装入________式滴定管进行滴定;
(3)向锥形瓶中滴加MnSO4溶液的作用是_____________________________________;判断已达滴定终点的现象是:_____________________________________;
(4)该滴定反应的离子方程式为:__________________________________________;
(5)实验测得草酸溶液的浓度为_____________mol/L;
(6)下列操作会引起实验结果偏高的是_____________
A.向锥形瓶中加入了较多 MnSO4溶液
B.滴定振摇时,锥形瓶中溶液溅出
C.滴定时,锥形瓶内壁附有紫红色溶液,未用蒸馏水冲洗
D.滴定结束时,仰视读数
用浓度为0.10 mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,其实验步骤如下:
I、滴定前的准备:
① → 用蒸馏水清洗 → 用待装溶液润洗 → 装液→ ② → 调节液面在零刻度或零刻度以下 → 记录初始读数
II、滴定:
分别取20.00 mL 草酸溶液于4个洁净的锥形瓶中,滴加几滴MnSO4溶液,然后用标准的KMnO4(H+)溶液进行滴定至终点,记录最终读数。数据如下:
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 初始读数(mL) | 0.40 | 0.10 | 0.90 | 0.00 |
| 最终读数(mL) | 25.05 | 20.10 | 21.00 | 19.90 |
| V标(mL) | 24.65 | 20.00 | 20.10 | 19.90 |
III、实验数据处理:略
请回答下列问题:
(1)将步骤I中的操作补充完整:
①__________________________
②__________________________
(2)KMnO4(H+)溶液应装入________式滴定管进行滴定;
(3)向锥形瓶中滴加MnSO4溶液的作用是_____________________________________;判断已达滴定终点的现象是:_____________________________________;
(4)该滴定反应的离子方程式为:__________________________________________;
(5)实验测得草酸溶液的浓度为_____________mol/L;
(6)下列操作会引起实验结果偏高的是_____________
A.向锥形瓶中加入了较多 MnSO4溶液
B.滴定振摇时,锥形瓶中溶液溅出
C.滴定时,锥形瓶内壁附有紫红色溶液,未用蒸馏水冲洗
D.滴定结束时,仰视读数
用已知物质的量浓度的NaOH溶液滴定未知浓度的盐酸时,可能有以下操作:
①用蒸馏水洗涤碱式滴定管后,直接装入已知浓度的NaOH溶液;
②经检查碱式滴定管不漏液,胶管中玻璃珠控制灵活后,用少量已知的NaOH溶液洗涤2~3次后再装入碱液,将液面调至刻度“0”处,用滴定管夹将其固定在铁架台上;
③用待测盐酸润洗移液管移取一定体积的待测盐酸溶液,放至用蒸馏水洗净的锥形瓶中;
④往锥形瓶中滴加几滴甲基橙,在瓶下垫一张白纸;
⑤手捏碱式滴定管中的玻璃珠,快速放液以使指示剂尽快变色;
⑥指示剂变色后再滴加几滴碱液,以稳定变色。
以上操作中错误的是( )
A.①②⑥ B.①②③
C.①⑤⑥ D.②③④
某同学利用下图装置,用0.1000mol/L的氢氧化钾溶液测定某未知浓度的盐酸溶液的物质的量浓度,,其操作可分解为如下几步:
A.用标准溶液润洗滴定管2~3次
B.取标准KOH溶液注入碱式滴定管至刻度0以上2~3cm
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.调节液面至0或0以下刻度,记下读数
E. 移取20.00mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
F. 把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,并记下滴定管液面的刻度读数。
G.把锥形瓶里的溶液倒掉,用蒸馏水把锥形瓶洗涤干净。按上述操作重复一次,并记下滴定前后液面刻度的读数。
就此实验完成填空:
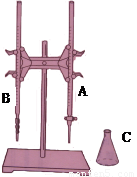
(1)上图所示是 常用的仪器,(填实验名称)。图中A是 (填仪器名称)
(2)判断到达滴定终点的实验现象是:___ ____
(3)上述E步骤操作之前,先用蒸馏水润洗锥形瓶,则对滴定结果的影响是
(填“偏高”、 “ 偏低”或“无影响”)。
(4)重复做该实验4次。所得实验数据如下表:
|
实验次数 |
c(KOH)/mol·L-1 |
B中起点刻度 |
B中终点刻度 |
V(HCl)/ml |
|
1 |
0.1000 |
0 |
24.95 |
25.00 |
|
2 |
0.1000 |
0 |
24.96 |
25.00 |
|
3 |
0.1000 |
0 |
24.50 |
25.00 |
|
4 |
0.1000 |
0 |
24.94 |
25.00 |
请你确定盐酸的物质的量浓度为 mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com