
题目列表(包括答案和解析)
(A)有机化学反应因反应条件不同,可生成不同的有机产品。例如:

苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。
工业上利用上述信息,按下列路线合成结构简式为 的物质,该物质是一种香料。
的物质,该物质是一种香料。

请根据上述路线,回答下列问题:
(1)A的结构简式可能为________________________。
(2)反应③⑤的反应类型分别为________________________、_____________________。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):_______________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是____________________________________________________________________。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色;②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):___________________________________。
28.(B)A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,C的非金属性最强,A、D同主族隔周期,E元素原子最外层的p亚层电子数是s亚层电子数的一半。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的电子式是________________________,C元素在周期表中的位置是___________________________。
(2)C和D的离子中,半径较小的是_____________(填离子符号)。
(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是___________________________________________________________________。
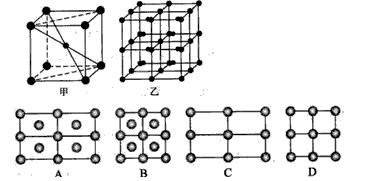
(4)C、D、E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用![]() 表示)位于正方体的棱的中点和正方体内部;阴离子
表示)位于正方体的棱的中点和正方体内部;阴离子![]() (用
(用![]() 表示)位于该正方体的顶点和面心。该化合物的化学式是________________。
表示)位于该正方体的顶点和面心。该化合物的化学式是________________。

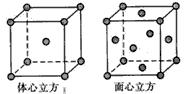
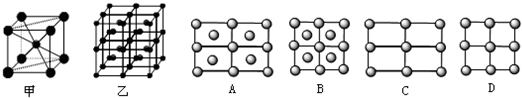
(5)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是( )
A.γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C.若δ-Fe晶胞边长为a cm,α-Fe晶胞边长为b cm,则两种晶体密度比为2b3∶a3
D.将铁加热到1



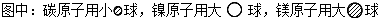






题号
1
2
3
4
5
6
7
8
答案
D
B
A
C
B
D
D
D
题号
9
10
11
12
13
14
答案
B
AC
CD
B
BD
AB
15、(1)2xCO + 2NOx ==== 2xCO2 + N2 (2分),
(2)步骤一、NH3的制取
① H(1分)
② f(1分)
因为NH4Cl受热易分解,生成的部分NH3和HCl又重新结合成NH4Cl(1分);
而用NaOH或Ca(OH)2作反应物产生的水较多,吸收的NH3较多(1分)。(意思
相近均给分)
步骤二、模拟尾气的处理
① 3Cu + 8H+ + 2NO3? == 3Cu2+ + 2NO↑ + 4H2O(2分)
② 防止氨气溶解(或防止倒吸) (1分)
③ c(1分)
④未反应的NO无法处理,会污染环境(1分)
16.(8分)⑴NH3;⑵2Al+Fe2O32Fe+Al2O3;
⑶2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
Al(OH)3+OH-=AlO2-+2H2O(每空2分)
17、(1)MnSO4;(2)增大溶液的pH,使Fe3+和 Al3+生成沉淀; 使形成胶体的氢氧化铝和氢氧化铁也生成沉淀; H2SO4;(3)Fe2O3、Al2O3、S ;(4)纯碱 、H2SO4;(5)降温结晶;(6)1.03(或1)
18、(1) H2 (g)+ 1/2 O2 (g)=H2O (l) △H = -285.8 kJ /mol
(2) H2 -2 e- +2OH- =2H2O (3)① t4~t5 ②
(4)B (每空2分,共10分 )
19、(1)C10H10O2 (1分) (2)A、C (2分)
 (3) (1分)
(3) (1分)
(4)①羧基、羟基 ②酯化反应“或取代反应”,(2分,各1分)
 (2分)
(2分)
③  (2分)
(2分)
20、(1)将绿色沉淀X用蒸馏水多次洗涤,至洗涤液中用BaCl2溶液检验不出SO42-后,用稀盐酸溶解绿色沉淀,此时再用BaCl2溶液检验,溶解液中有白色沉淀生成,则说明沉淀X中有SO42-……………………2分
(2)Cu2O+2H+=Cu+Cu2+ +H2O……………………2分
(3)因为Cu2O∶Cu=0.454∶0.128 可判断Y为Cu2O
根据硫酸铜溶液跟氢氧化钠溶液混合生成沉淀,可设沉淀组成为mCu(OH)2?nCuSO4,则有(98m+160n)∶144×(m+n) /2=0.454∶0.288
即可得m∶n=3∶1,所以X为3Cu(OH)2?CuSO4或Cu4(OH)6SO4………………2分
(4)4∶3…………………2分;Cu4(OH)6SO4 2Cu2O+3H2O↑+SO3↑+O2↑………
2Cu2O+3H2O↑+SO3↑+O2↑………
 21、A(1)
21、A(1)  (2分)
(2分)
(2) 6(1分) (1分)
(3) 分子晶体 (1分) bc (2分)
(4) A (2分)
(5) MgCNi3 (2分) 12 (1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com