
题目列表(包括答案和解析)
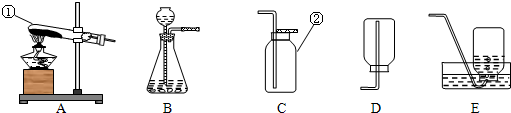
| ||
| ||
| ||
| ||
| 你对气体Y的推测 | 实验初步验证的方法 | 实验现象 |
| 气体Y可能是 O2 O2 (填化学式) |
将带火星的木条伸入集气瓶内 将带火星的木条伸入集气瓶内 |
若带火星木条复燃,说明制取的是氧气 若带火星木条复燃,说明制取的是氧气 |
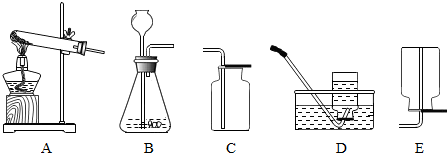
(7分)某化学兴趣小组的同学在老师的指导下,开展如下探究活动。
探究一:A、B、C、D分别是碳酸钠、氢氧化钠、氢氧化钙、硫酸钠中的一种,它们之间的转化关系如图一所示。(“→”表示物质之间的转化关系,“—”表示物质之间可以发生化学反应)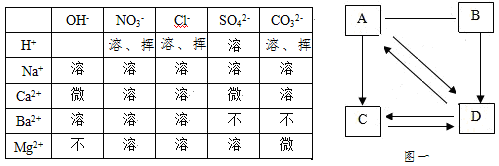
(1)四种物质中,属于盐类的物质是 (填化学式,下同)
(2)物质D是 。
探究二:设计一个优化的实验方案,验证某氯化钠溶液中混有碳酸钠、硫酸钠和氢氧化钠并提纯氯化钠,其实验流程及部分实验现象如下图二所示。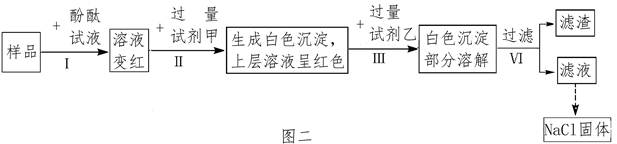
(3)样品溶液的pH 7(填“大于”、“等于”或“小于”),试剂甲是 溶液;
(4)第Ⅲ步实验中还可观察到的现象是 ;
(5)证明药品中含有氢氧化钠的证据是 ;第Ⅳ步所得滤液中除指示剂外,还含有的溶质是 。


 、
、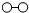 、
、 分别表示N2、H2、NH3.在催化剂表面(下图中
分别表示N2、H2、NH3.在催化剂表面(下图中 表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:


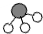
 、
、 、
、 分别表示N2、H2、NH3.在催化剂表面(下图中
分别表示N2、H2、NH3.在催化剂表面(下图中 表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com